抗HIV治療ガイドライン
抗HIV治療ガイドライン第5章(2023年3月版)
Naive
表V-2 初回治療として選択すべき抗HIV薬の組み合わせ
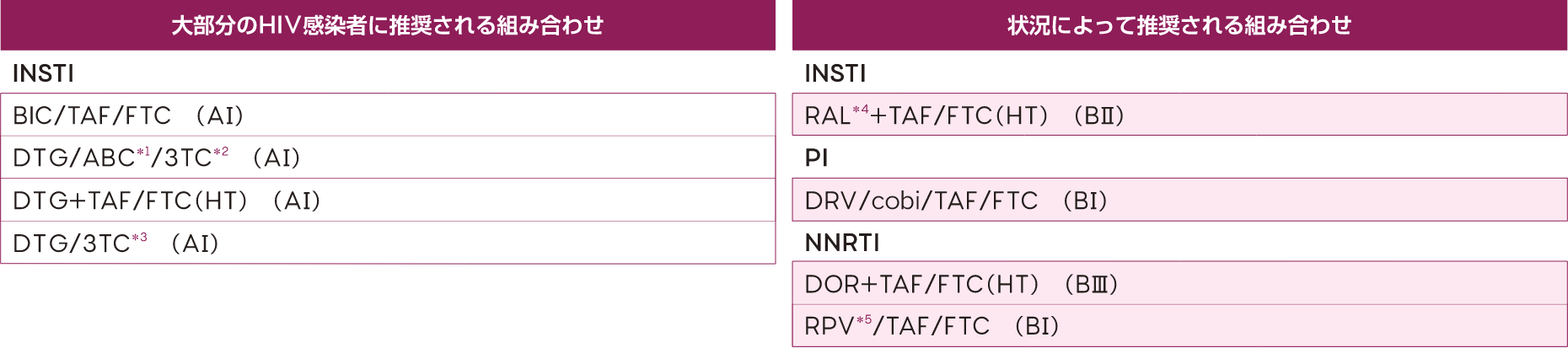
☆キードラッグが同じクラス内では推奨順とし、推奨レベルが同じ場合は、アルファベット順とした。
☆薬剤の略称は表V-1を参照。
注1) RAL 400mg錠以外はすべてQD(1日1回)。RAL 600mg錠は、1200mgを1日1回。
注2) cobiはCYP阻害作用を有するので、薬物相互作用に注意が必要(詳細は添付文書を参照)。
注3) 配合剤が入手困難な場合は個別の薬剤の組み合わせでもよい。
*1 HLA B*5701を有する患者(日本人では稀)ではABCの過敏症に注意を要する。ABC投与により心筋梗塞の発症リスクが高まるという報告がある。
*2 DTG/ABC/3TCはB型肝炎の合併がない患者にのみ推奨。
*3 DTG/3TCはB型肝炎の合併がなく、血中HIV RNA量が50万コピー/mL未満、薬剤耐性検査で3TC、DTGに耐性のない患者にのみ推奨。
*4 RALはRAL 600mg錠の2錠(1200mg)を1日1回内服か、RAL 400mg 1錠を1日2回内服が可能。
*5 RPVは血中HIV RNA量が10万コピー/mL未満の患者にのみ推奨。RPVはプロトンポンプ阻害剤内服者には使用しない。
3TC=ラミブジン ABC=アバカビル BIC=ビクテグラビル DOR=ドラビリン DRV=ダルナビル DTG=ドルテグラビル FTC=エムトリシタビン RAL=ラルテグラビル RPV=リルピビリン TAF=テノホビル アラフェナミド cobi=コビシスタット

[令和4年度厚生労働行政推進調査事業費補助金エイズ対策政策研究事業
HIV感染症および血友病におけるチーム医療の構築と医療水準の向上を目指した研究班による「抗HIV治療ガイドライン(2023年3月版)」]
PM-JP-HVX-WCNT-230002 作成年月日2023年8月

