海外データ
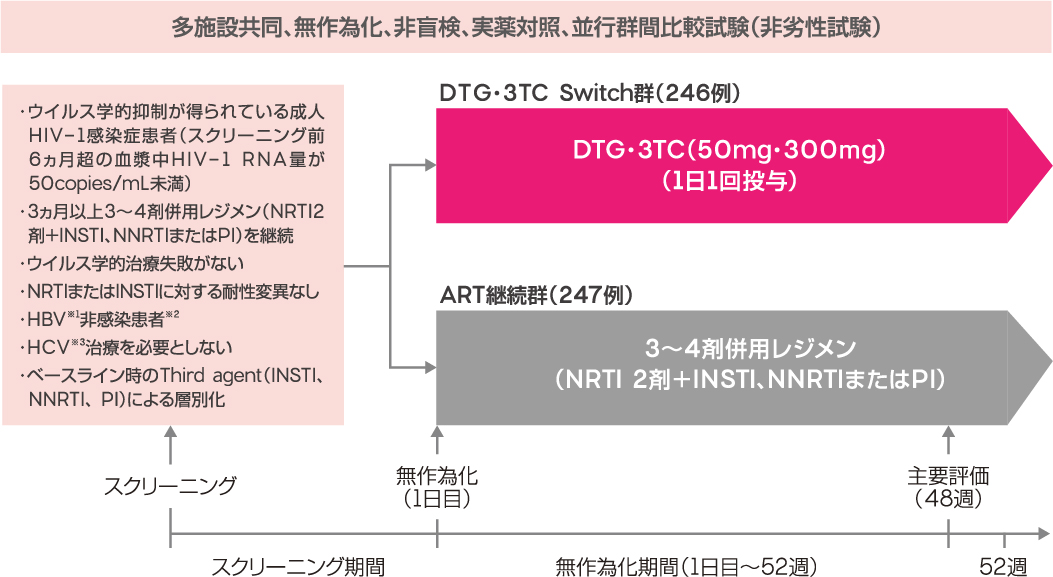
ウイルス学的抑制が得られている成人HIV-1感染患者を対象とした非盲検比較検証試験(非劣性試験)
【目的】
ウイルス学的抑制が得られている成人HIV-1感染症患者において、3~4剤併用レジメン(NRTI2剤+INSTI、NNRTIまたはPI)からドルテグラビル・ラミブジン(DTG・3TC)へ切り替えた場合の有効性を検証するとともに、安全性、忍容性を評価する。
【対象】
ウイルス学的抑制が得られている成人HIV-1感染症患者493例[ウイルス学的治療失敗(CVF※1)がない、スクリーニング前6ヵ月超の血漿中HIV-1 RNA量が50copies/mL未満、3ヵ月以上3~4剤併用レジメン(NRTI2剤+INSTI、NNRTIまたはPI)を継続]
【方法】
多施設共同、無作為化、非盲検、実薬対照、並行群間比較検証試験(非劣性試験)
対象患者を、ドウベイト(DTG・3TC:50mg・300mg)を1日1回投与するDTG・3TC Switch群と、現在の3~4剤併用レジメン(NRTI2剤+INSTI、NNRTIまたはPI)を継続投与するART継続群の2群に無作為に割り付けた。投与48週時の有効性について、ART継続群に対するDTG・3TC Switch群の非劣性を検証した。
評価項目
【有効性】
主要評価項目(検証的な解析項目):
投与48週時における血漿中HIV-1 RNA量≧50copies/mLであった患者の割合
副次評価項目:
投与48週時における血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合、投与48週時におけるベースライン時からのCD4陽性リンパ球数及びCD4陽性/CD8陽性比の変化量、CVW※2が認められた患者における耐性変異(表現型/遺伝子型)の発現率
【安全性】
有害事象、臨床検査値異常、有害事象による投与中止、空腹時脂質の変化率、骨代謝マーカーの変化量、腎機能関連マーカーの変化量/変化率、及び炎症バイオマーカーのベースライン時からの変化など
NRTI:核酸系逆転写酵素阻害薬、INSTI:インテグラーゼ阻害薬、NNRTI:非核酸系逆転写酵素阻害薬、PI:プロテアーゼ阻害薬
※1 CVF(confirmed virologic failure)の定義:ウイルス学的無効[投与8週目までの血漿中HIV-1 RNA量減少が<2.0 log10 copies/mL(<200copies/mLの場合を除く)、投与12週目に血漿中HIV-1 RNA量≧1000copies/mL、または投与24週目以降に血漿中HIV-1 RNA量≧200copies/mLが検出された場合]またはウイルス学的リバウンド(血漿中HIV-1 RNA量<200copies/mLに至った後に血漿中HIV-1 RNA量≧200copies/mLに再上昇した場合)が認められた場合。
※2 CVW:Confirmed Virologic Withdrawal
【解析計画】
有効性及び安全性の解析対象はITT-E集団(無作為化され、1回以上治験薬を投与された集団)とした。投与48週時における血漿中HIV-1 RNA量≧50copies/mLであった患者の割合(主要評価項目)及び血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合(副次評価項目)は、FDA Snapshotアルゴリズム解析によって算出し、両群間の差はCochran-Mantel-Haenszel検定を用いてベースライン時のThird agent(INSTI、NNRTI、 PI)で調整後に算出した。それぞれの非劣性マージンは5%及び-12%とした。また、投与48週時におけるベースライン時からのCD4陽性リンパ球数及びCD4陽性/CD8陽性比の変化量の中央値を評価した。さらに、2回連続して血漿中HIV-1 RNA量≧50copies/mL(2回目は血漿中HIV-1 RNA量≧200copies/mL)が検出された場合をCVW※1とプロトコールで規定し、投与48週時にCVWが認められた患者における耐性変異の発現を検討することとした。
空腹時脂質の変化については、治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、対数変換したベースライン時の値、治療と来院の相互関係、対数変換したベースライン値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRM※2を用いて算出した。骨代謝マーカーの変化については、治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM※2を用いて算出した。腎機能関連マーカーの変化については、血漿/血清マーカーでは治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、糖尿病及び高血圧の既往、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM※2を用いて算出し、尿マーカーでは対数変換したベースライン時のバイオマーカー値を調整する以外は血漿/血清マーカーと同様のモデルに基づき算出した。炎症バイオマーカーの変化については、治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、C型肝炎ウイルス感染状況、対数変換したベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRM※2を用いて算出した。
※1 CVW:Confirmed Virologic Withdrawal
※2 MMRM:Mixed Model Repeated Measures
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
NRTI:核酸系逆転写酵素阻害薬、INSTI:インテグラーゼ阻害薬、NNRTI:非核酸系逆転写酵素阻害薬、PI:プロテアーゼ阻害薬
※1 B型肝炎ウイルス
※2 スクリーニング時のHBV HBs抗原、抗HBc抗体、抗HBs抗体、HBV DNA検査結果に基づきHBV感染症と考えられる以下の者を除外した患者
- HBs抗原陽性者
- 抗HBs抗体陰性で抗HBc抗体陽性(HBs抗原陰性)かつHBV DNA陽性者
注:抗HBc抗体陽性(HBs抗原陰性)かつ抗HBs抗体陽性者(過去及び/または現在の感染を示す)はHBVに対する免疫があり、除外しない。
※3 C型肝炎ウイルス
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
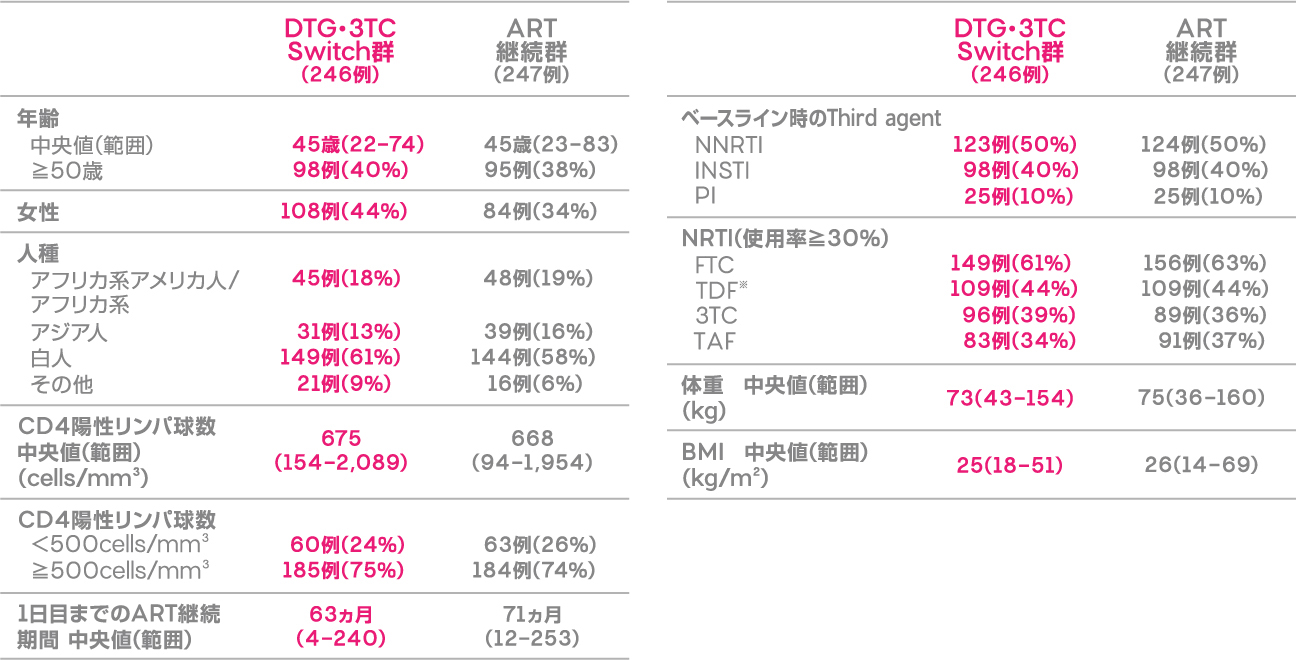
患者背景
患者背景(ITT-E集団)
NNRTI:非核酸系逆転写酵素阻害薬、INSTI:インテグラーゼ阻害薬、PI:プロテアーゼ阻害薬、
FTC:エムトリシタビン、TDF:テノホビル ジソプロキシルフマル酸塩、3TC:ラミブジン、TAF:テノホビル アラフェナミド
※テノホビル ジソプロキシルコハク酸塩を含む(DTG・3TC Switch群:1例、ART継続群:3例)
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
投与48週時において血漿中HIV-1 RNA量≧50copies/mLであった患者の割合は、DTG・3TC Switch群で0.4%(1/246例)、ART継続群で1.2%(3/247例)であり、ART継続群に対するDTG・3TC Switch群の非劣性が検証されました[調整後の差※:-0.8%(95%CI:-2.4,0.8):ITT-E集団]。
血漿中HIV-1 RNA量≧50copies/mLであった患者の割合(投与48週時、ITT-E集団)(主要評価項目:検証的な解析結果)
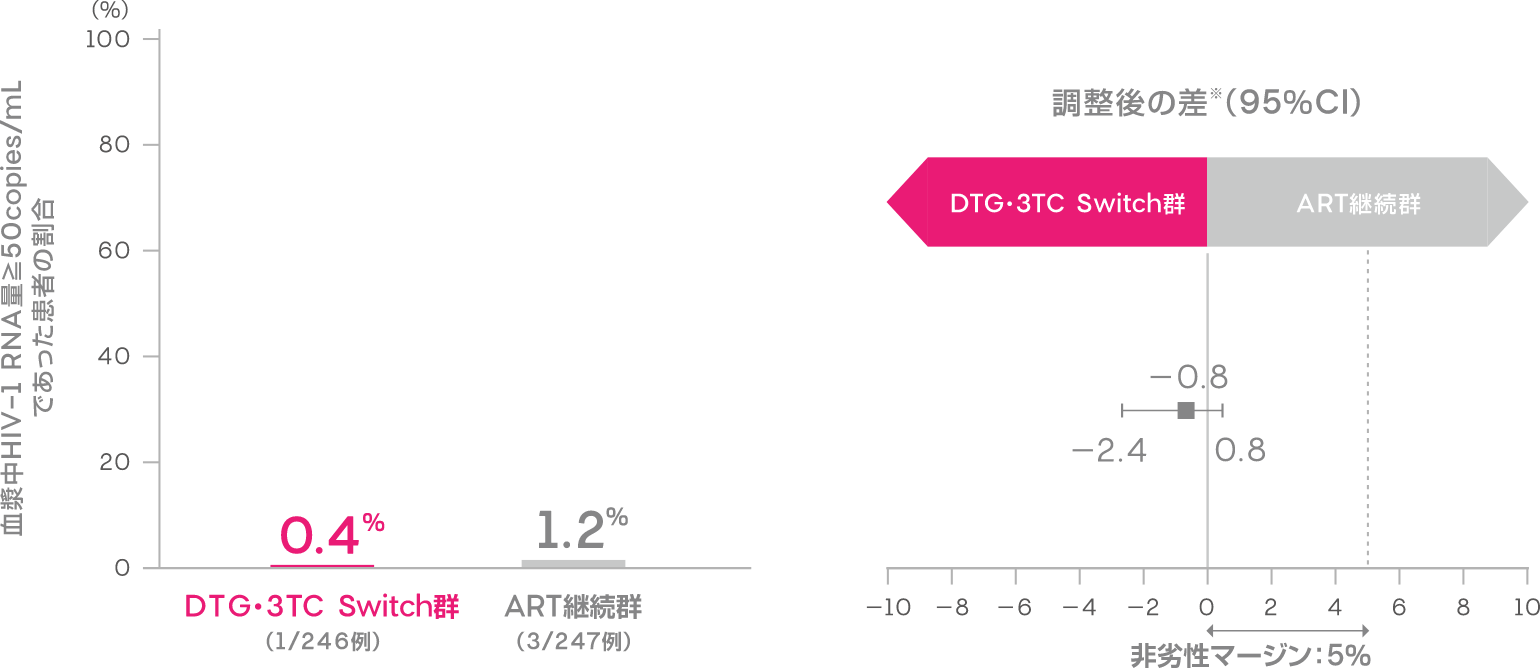
FDA Snapshotアルゴリズム解析
※Cochran-Mantel-Haenszel検定を用いた層別解析に基づく調整済みの差(非劣性マージン:5%)
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
(副次評価項目)
投与48週時において血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合は、DTG・3TC Switch群で94%(232/246例)、ART継続群で93%(229/247例)でした[調整後の差※:1.6%(95%CI:-2.8,5.9):ITT-E集団]。
血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合(投与48週時、ITT-E集団)(副次評価項目)
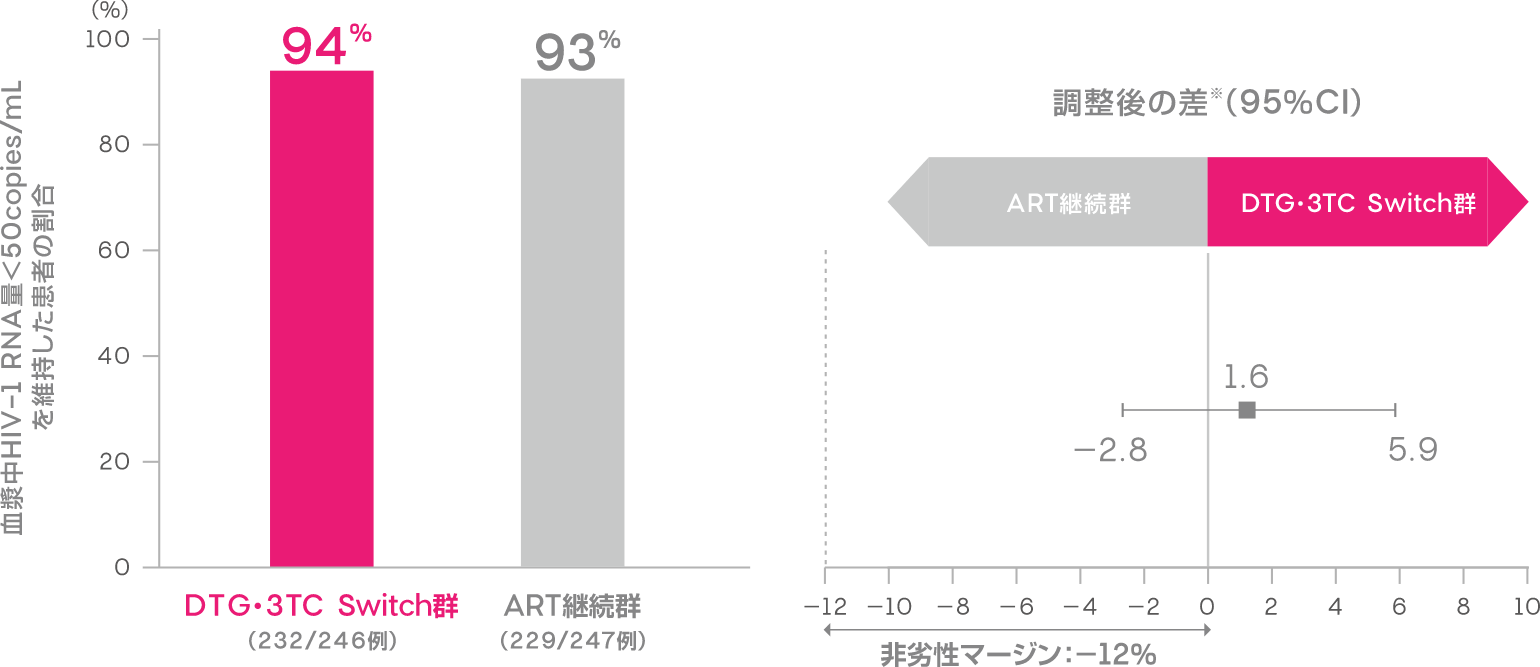
FDA Snapshotアルゴリズム解析
※Cochran-Mantel-Haenszel検定を用いた層別解析に基づく調整済みの差(非劣性マージン:-12%)
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
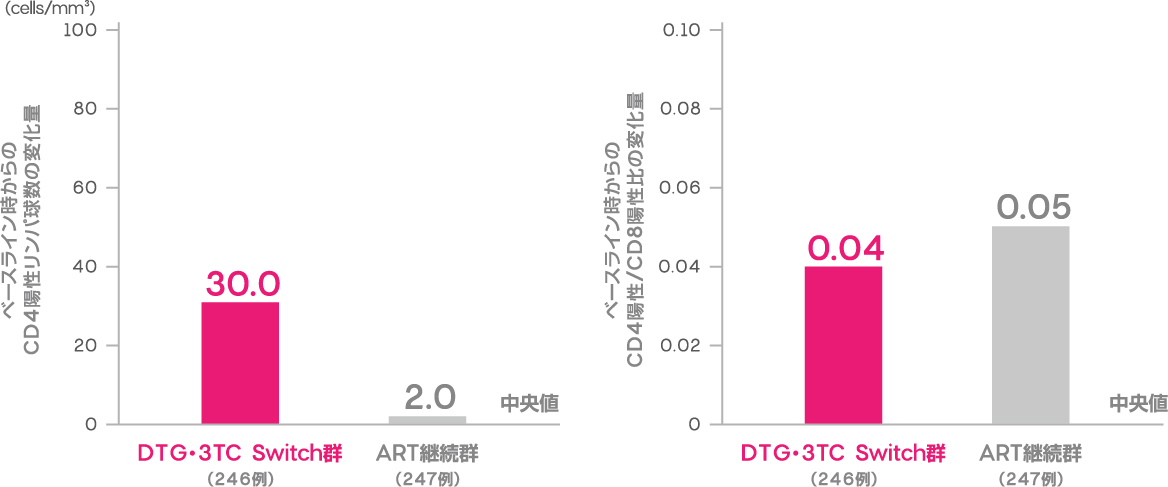
CD4陽性リンパ球数及びCD4陽性/CD8陽性比の変化量
(副次評価項目)
投与48週時におけるベースライン時からのCD4陽性リンパ球数の変化量(中央値)はDTG・3TC Switch群で30.0cells/mm3、ART継続群で2.0cells/mm3、CD4陽性/CD8陽性比の変化量(中央値)はDTG・3TC Switch群で0.04、ART継続群で0.05でした。
ベースライン時からのCD4陽性リンパ球数及びCD4陽性/CD8陽性比の変化量(投与48週時、ITT-E集団)(副次評価項目)
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
耐性変異の出現
(副次評価項目)
いずれの投与群においても、投与48週時までにCVW※の基準を満たした患者は認められませんでした。
そのため、耐性検査は実施しませんでした。
※CVW(Confirmed Virologic Withdrawal)の定義:2回連続して血漿中HIV-1 RNA量≧50copies/mL(2回目は血漿中HIV-1 RNA量≧200copies/mL)が検出された場合。
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
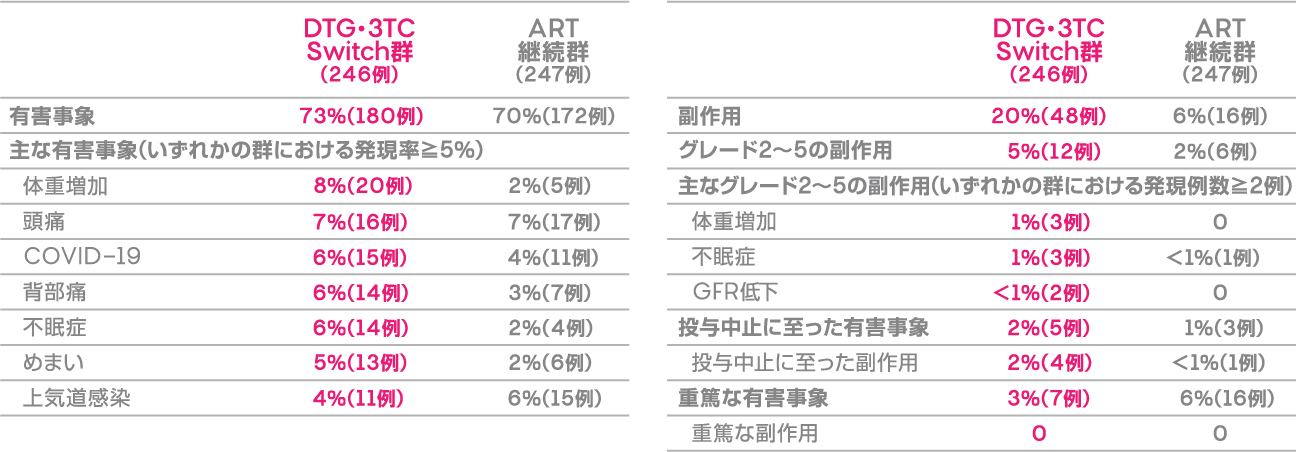
本試験における投与48週後の有害事象発現率は、DTG・3TC Switch群で73%(180/246例)、ART継続群で70%(172/247例)でした。主な有害事象(いずれかの群における発現率≧5%)は下表のとおりでした。 副作用発現率は、DTG・3TC Switch群で20%(48/246例)、ART継続群で6%(16/247例)でした。
重篤な有害事象は、DTG・3TC Switch群では7例であり、COVID-19感染、肛門膿瘍、気管炎、消化管間質性腫瘍、白内障、死亡、流産が各1例、ART継続群では16例であり、COVID-19感染3例、細菌性肺炎2例、蜂巣炎、胃腸炎、良性下垂体腫瘍、子宮頸部扁平上皮癌、大腿骨頸部骨折、処置後合併症、急性心筋合併症、椎間板ヘルニア、意識レベル低下、腎障害、前立腺肥大症、肺塞栓症、深部静脈血栓症が各1例でした。
投与中止に至った有害事象は、DTG・3TC Switch群では5例であり、その内訳は不眠症2例、アルコール乱用、不安、死亡(薬剤と関連なし)、体重増加が各1例、ART継続群では3例であり、その内訳は自殺念慮、潰瘍性大腸炎(薬剤と関連なし)、術後合併症(薬剤と関連なし)が各1例でした。死亡はDTG・3TC Switch群で1例に認められました(死因不明)。
有害事象発現率 (投与48週後)
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
脂質への影響
(安全性評価項目)
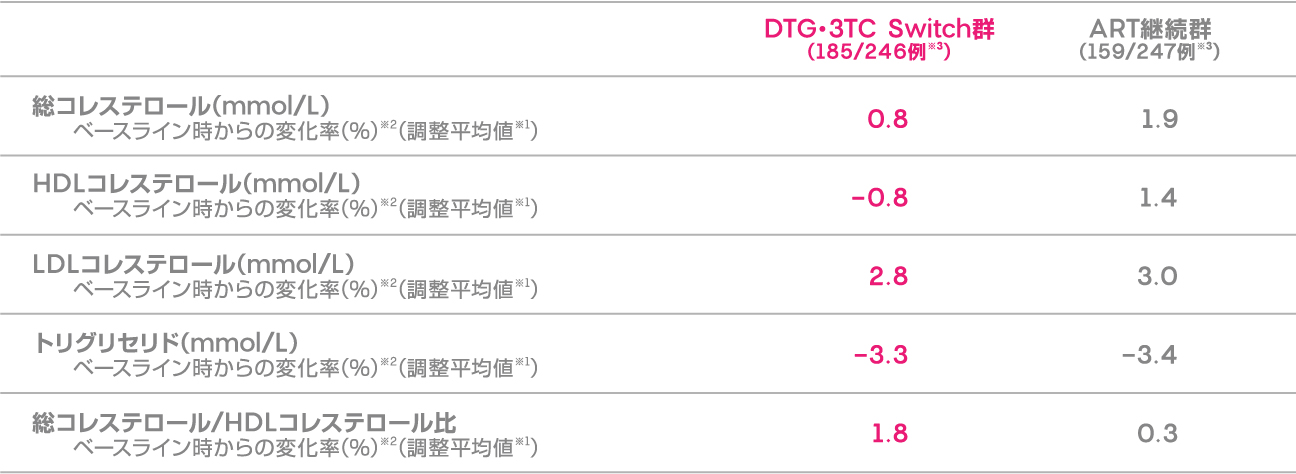
投与48週時におけるDTG・3TC Switch群及びART継続群の空腹時脂質のベースライン時からの変化率(調整平均値※1)を下記に示します。
ベースライン時からの空腹時脂質の変化率 (投与48週時)(安全性評価項目)
※1 治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、対数変換したベースライン時の値、治療と来院の相互関係、対数変換したベースライン値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 48週時/ベースライン時の調整比で示す。
※3 ベースライン時及び48週時の空腹時脂質値のデータがある患者で、ベースライン時に脂質異常症治療薬を投与している患者は除外した(脂質異常症治療薬の投与を開始した後は空腹時脂質の評価を打ち切った)。
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
骨への影響
(安全性評価項目)
投与48週時におけるDTG・3TC Switch群及びART継続群の骨代謝マーカーのベースライン時からの変化量(調整平均値※1)を下記に示します。
ベースライン時からの骨代謝マーカーの変化量 (投与48週時)(安全性評価項目)
※1 各群のベースラインからの推定平均変化量は、治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 ベースライン時及び48週時のデータがある患者
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
腎機能への影響
(安全性評価項目)
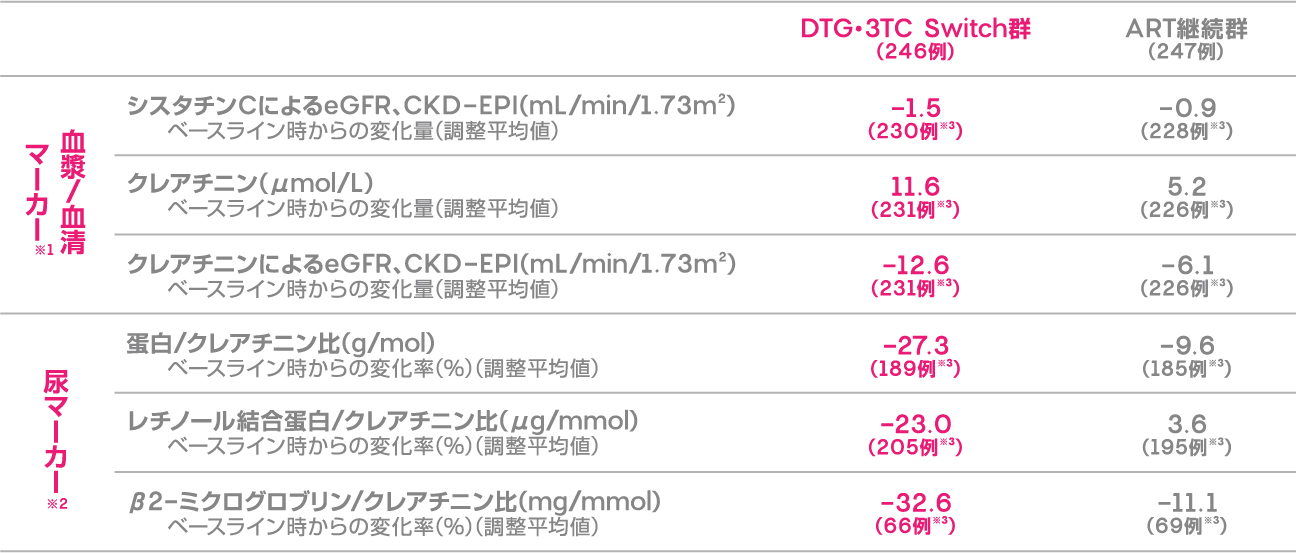
投与48週時におけるDTG・3TC Switch群及びART継続群の腎機能関連マーカーのベースライン時からの変化(調整平均値)を下記に示します。
ベースライン時からの腎機能関連マーカーの変化 (投与48週時)(安全性評価項目)
※1 各群のベースラインからの推定平均変化量は、治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、糖尿病及び高血圧の既往、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 48週時/ベースライン時の推定調整比で示す。対数変換したベースライン時のバイオマーカー値を調整する以外は、血漿/血清マーカーと同様のモデルに基づく。
※3 ベースライン時及び48週時のデータがある患者
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
炎症への影響
(安全性評価項目)
投与48週時におけるDTG・3TC Switch群及びART継続群の炎症バイオマーカーの変化(対ベースライン比※)を下記に示します。
炎症バイオマーカーの変化(対ベースライン比) (投与48週時)(安全性評価項目)
※治療、来院、ベースライン時のThird agent、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、C型肝炎ウイルス感染状況、対数変換したベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて各群のベースラインからの変化量を算出し、48週時/ベースライン時の推定調整比で示した。
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
SALSA試験 LImItatIon
本試験においてはART継続群に多様なレジメンが含まれているため、結果の一般化に拡大解釈できるが、個々のレジメンの差のような変動性が増加するため、一般化可能性を見出すことは困難である。
[Llibre JM, et al.: Clin Infect Dis, 76(4), 720-729(2023)]
PM-JP-DLL-WCNT-220004 | 作成年月2024年12月