GEMINI-1及びGEMINI-2試験の併合解析
海外データ
HIV感染症治療による治療経験のない成人HIV感染症患者を対象とした二重盲検比較検証試験(非劣性試験)
試験概要
【目的】
HIV感染症治療(ART)による治療経験のない成人HIV-1感染症患者において、ドルテグラビル(DTG)+テノホビルジソプロキシルフマル酸塩・エムトリシタビン(TDF・FTC)配合剤の3剤併用療法を対照に、DTG+ラミブジン(3TC)の2剤併用療法の非劣性を検証する。
【対象】
ARTによる治療経験のない※1成人HIV-1感染症患者1,433例(スクリーニング時の血漿中HIV-1 RNA量が1,000~500,000copies/mL)
【方法】
多施設共同、無作為化、二重盲検、実薬対照、並行群間比較検証試験(非劣性試験)
対象患者を、DTG(50mg)+3TC(300mg)を1日1回投与するDTG+3TC群とDTG(50mg)+TDF・FTC(300mg・200mg)を1日1回投与するDTG+TDF・FTC群の2群に無作為に割り付けた。投与48週時、96週時及び144週時の有効性について、DTG+TDF・FTC群に対するDTG+3TC群の非劣性を検証(投与48週時)ならびに検討(投与96週時及び144週時)するとともに、投与24週時/48週時/96週時/144週時の有効性、投与24週時/48週時/96週時/144週時の安全性及び忍容性についても評価した。
評価項目
【有効性】
主要評価項目(検証的な解析):
投与48週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合※2、ウイルス学的治療アウトカム
副次評価項目:
投与96週時及び144週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合※2、ウイルス学的治療アウトカム
投与48週時及び96週時におけるベースライン時からの血漿中HIV-1 RNA変化量
投与48週時、96週時及び144週時におけるベースライン時の血漿中HIV-1 RNA量/CD4陽性リンパ球数別の抗ウイルス効果※2など
ウイルス学的エンドポイント:投与48週時、96週時及び144週時における耐性変異の発現
【安全性】
有害事象発現率、腎機能(腎血清マーカー:クレアチニン、クレアチニンによるeGFR、シスタチンCによるeGFR、尿マーカー:蛋白/クレアチニン比、β2-ミクログロブリン/クレアチニン比、レチノール結合蛋白/クレアチニン比)、骨(骨代謝マーカー:血清骨型アルカリフォスファターゼ、血清オステオカルシン、血清Ⅰ型プロコラーゲンN-末端プロペプチド、血清Ⅰ型コラーゲンC-テロペプチド)、脂質(総コレステロール、HDLコレステロール、LDLコレステロール、トリグリセリド、総コレステロール/HDLコレステロール比)への影響など
【解析計画】
本試験は、事前に規定された併合解析(GEMINI-1試験とGEMINI-2試験)を行った。投与48週時/96週時/144週時の有効性については、非劣性マージンを-10%とし、DTG+TDF・FTC群に対するDTG+3TC群の非劣性を検証(投与48週時)及び検討(投与96週時/144週時)した。両群の奏効率※3は、FDA Snapshotアルゴリズム解析によって算出し、両群間の奏効率の差はCochran-Mantel-Haenszel weightを用いた層別解析に基づいて調整後、算出した。主要評価項目及び副次評価項目の評価についてはITT-E集団※4を用いてFDA Snapshotアルゴリズム解析によって評価した。また、主要評価項目について、事前に規定されているサブグループ(ベースライン時の血漿中HIV-1 RNA量、CD4陽性リンパ球数)別の解析を行った。なお、サブグループ解析についてはFDA Snapshotアルゴリズム解析及びTRDF※5解析を行うことと事前に規定した。さらに、2回連続してウイルス学的無効〔投与12週目までの血漿中HIV-1 RNA量減少が<1 log10 copies/mL(<200copies/mLの場合を除く)、または投与24週目以降に血漿中HIV-1 RNA量≧200copies/mLが検出された場合〕またはウイルス学的リバウンド(血漿中HIV-1 RNA量<200copies/mLに至った後に血漿中HIV-1 RNA量≧200copies/mLに再上昇した場合)が認められた場合をCVW※6とプロトコールで規定し、投与48週時及び96週時にCVWが認められた患者における耐性変異の発現を検討した。腎機能(腎血清マーカー、尿マーカー)、骨(骨代謝マーカー)への影響については、投与48週時はベースライン時からの変化量の調整平均値をANCOVAで算出し、欠測値はMarkov chain Monte Carlo approachを用いたMultivariate Normal modelによって補完した。また、投与96週時及び144週時は、試験、治療、来院、ベースライン時の血漿中HIV-1 RNA量、ベースライン時のCD4陽性リンパ球数、年齢、性別、人種、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係、さらに糖尿病及び高血圧の既往(腎機能への影響)、BMI、喫煙状況、ビタミンD製剤使用有無(骨への影響)を因子として調整したMMRM※7を用いて解析した。脂質への影響については、投与144週時に試験、治療、来院、ベースライン時の血漿中HIV-1 RNA量、ベースライン時のCD4陽性リンパ球数、年齢、性別、人種、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を因子として調整したMMRMを用いて解析した。
※1 過去にいずれのART(10日超)も受けていない患者
※2 ITT-E集団におけるFDA Snapshotアルゴリズム解析を実施(層別解析にはCochran-Mantel-Haenszel weightを用いた)
※3 血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
※4 ITT-E集団:無作為化され、1回以上治験薬を投与された集団
※5 TRDF:Treatment-Related Discontinuation equals Failure
※6 CVW:Confirmed Virologic Withdrawal
※7 MMRM:Mixed Model Repeated Measures
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、アドバイザリーボード、コンサルタント、研究者としてヴィーブヘルスケア(株)を支援した者及びヴィーブヘルスケア(株)の社員が含まれる。
試験デザイン
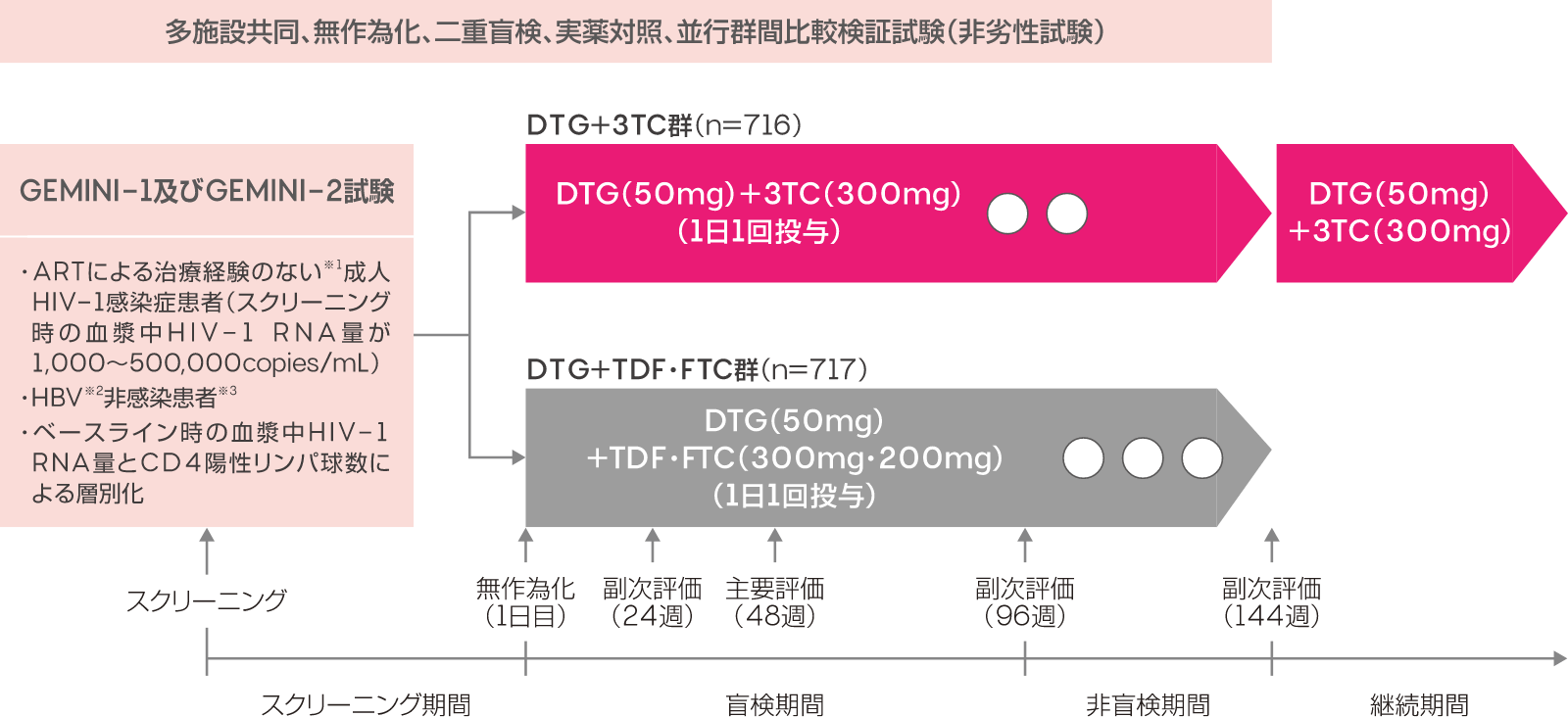
※1 過去にいずれのART(10日超)も受けていない患者
※2 B型肝炎ウイルス
※3 スクリーニング時のHBV HBs抗原、抗HBc抗体、抗HBs抗体またはHBs抗体、及びHBV DNAの検査結果に基づくHBV感染症と考えられる以下の者を除外した患者
- HBs抗原陽性者
- 抗HBs抗体陰性で抗HBc抗体陽性(HBs抗原陰性)かつHBV DNA陽性者
注:抗HBc抗体陽性(HBs抗原陰性かつHBV RNA陰性)及び抗HBs抗体陽性者(過去、及び/または現在の感染を示す)はHBVに対する免疫があり、除外しない
[承認時評価資料:海外臨床試験〔GEMINI-1(204861)及びGEMINI-2(205543)試験の併合解析〕]
[Cahn P, et al.: Lancet, 393(10167), 143-155(2019)]
[Cahn P, et al.: J Acquir Immune Defic Syndr, 83(3), 310-318(2020)]
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、アドバイザリーボード、コンサルタント、研究者としてヴィーブヘルスケア(株)を支援した者及びヴィーブヘルスケア(株)の社員が含まれる。
また、著者には、ヴィーブヘルスケア(株)が過去に、教育関係イベント等の演者、議長、アドバイザリーボードメンバーとしての謝礼、講演料、コンサルタント料、研究費等を支払った者が含まれる。]
患者背景
患者背景(ITT-E集団)
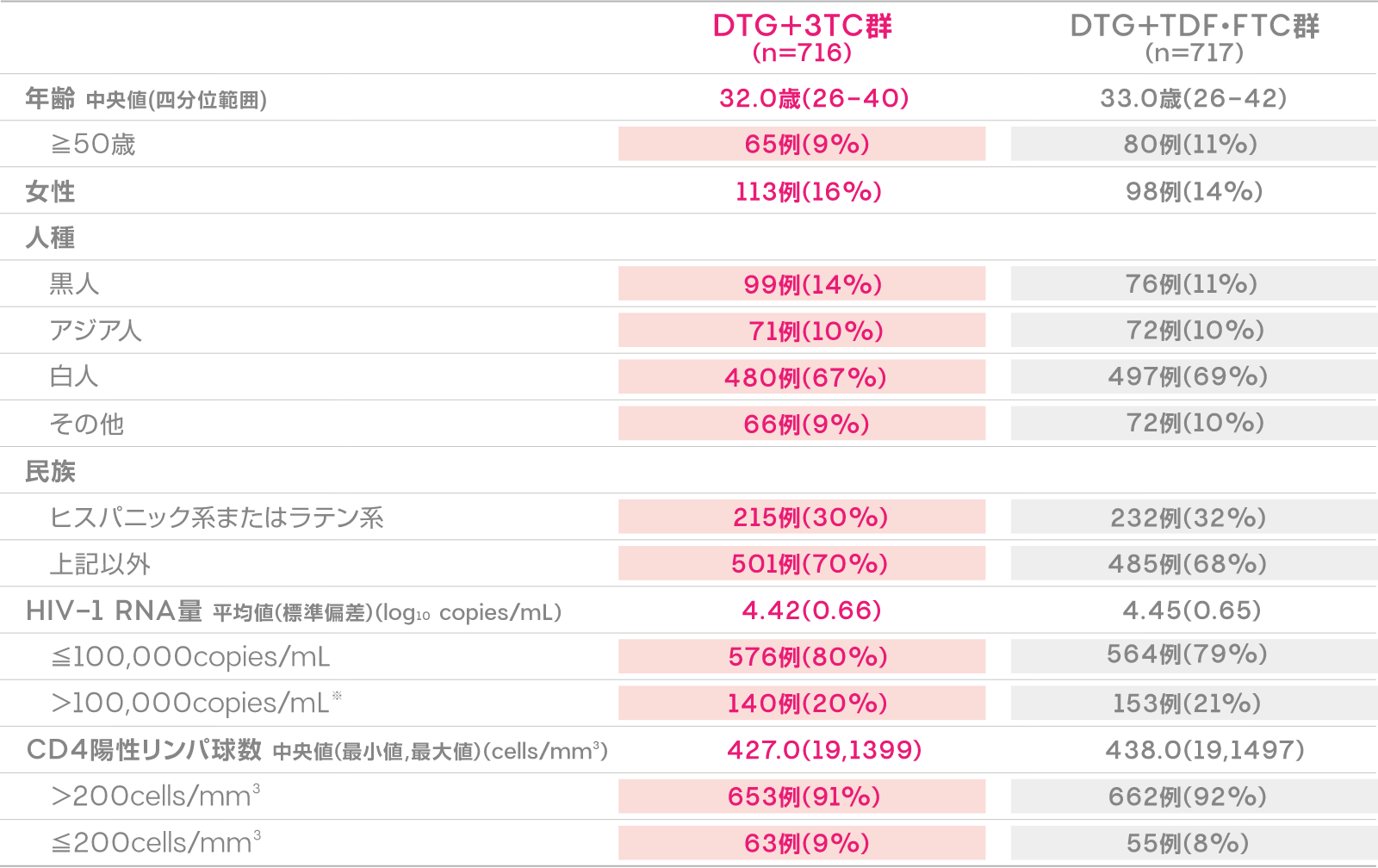
※ 各群2%の患者がベースライン時の血漿中HIV-1 RNA量≧500,000copies/mLであった。
[Cahn P, et al.: Lancet, 393(10167), 143-155(2019)より改変]
抗ウイルス効果
(主要及び副次評価項目)
投与48週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は、DTG+3TC群で91%(655/716例)、DTG+TDF・FTC群で93%(669/717例)であり、DTG+TDF・FTC群に対するDTG+3TC群の非劣性が検証されました[調整後の差※:-1.7%(95%CI:-4.4, 1.1):ITT-E集団]。また、投与96週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は、DTG+3TC群で86%(616/716例)、DTG+TDF・FTC群で90%(642/717例)でした[調整後の差※:-3.4%(95%CI:-6.7, 0.0):ITT-E集団]。
さらに投与144週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は、DTG+3TC群で82%(584/716例)、DTG+TDF・FTC群で84%(599/717例)でした[調整後の差※:-1.8%(95%CI:-5.8, 2.1):ITT-E集団]。
※1 Cochran-Mantel-Haenszel weightを用いた層別解析に基づく調整済みの差(非劣性マージン:-10%)
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
(投与48週時、96週時及び144週時、ITT-E集団)(主要及び副次評価項目)
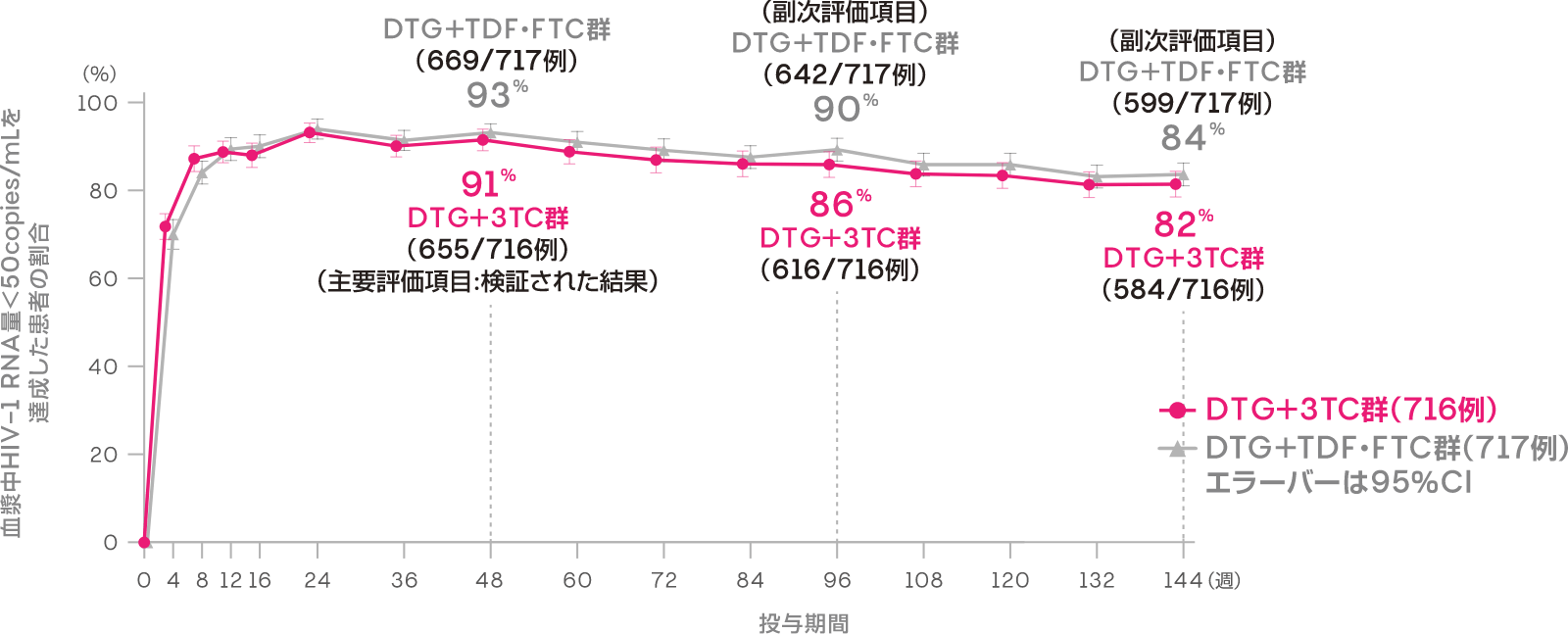
FDA Snapshotアルゴリズム解析
[Cahn P, et al.: J Acquir Immune Defic Syndr, 83(3), 310-318(2020)]
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
抗ウイルス効果
(投与144週)(副次評価項目)
投与144週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は、DTG+3TC群で82%(584/716例)、DTG+TDF・FTC群で84%(599/717例)でした[調整後の差※1:-1.8%(95%CI:-5.8, 2.1):ITT-E集団]。
※1 Cochran-Mantel-Haenszel weightを用いた層別解析に基づく調整済みの差(非劣性マージン:-10%)
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
(投与144週時、ITT-E集団)(副次評価項目)
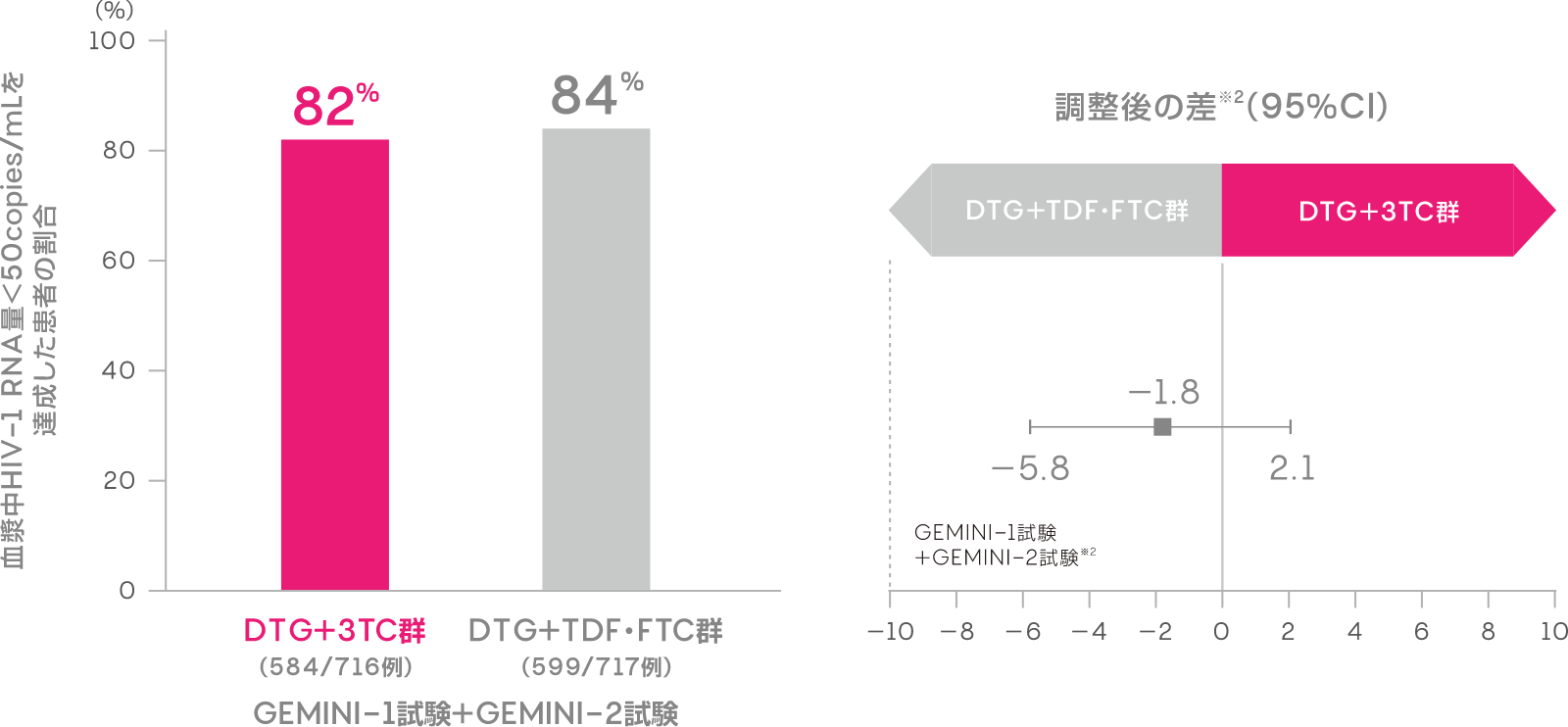
FDA Snapshotアルゴリズム解析
※2 ベースライン時の血漿中HIV-1 RNA量(≦100,000 vs >100,000copies/mL)、ベースライン時のCD4陽性リンパ球数(≦200 vs >200cells/mm3)及び試験(GEMINI-1 vs GEMINI-2)で調整したCochran-Mantel-Haenszel weightを用いた層別解析に基づく(非劣性マージン:ー10%)。
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)より改変]
ベースライン時における
血漿中HIV-1 RNA量別抗ウイルス効果
(投与144週)(副次評価項目:サブグループ解析)
ベースライン時の血漿中HIV-1 RNA量≦100,000copies/mL及び>100,000copies/mLの患者における投与144週時の血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は、DTG+3TC群でそれぞれ81%(469/576例)、82%(115/140例)、DTG+TDF・FTC群で84%(471/564例)、84%(128/153例)でした。
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
(投与144週時、ITT-E集団)(副次評価項目:サブグループ解析)
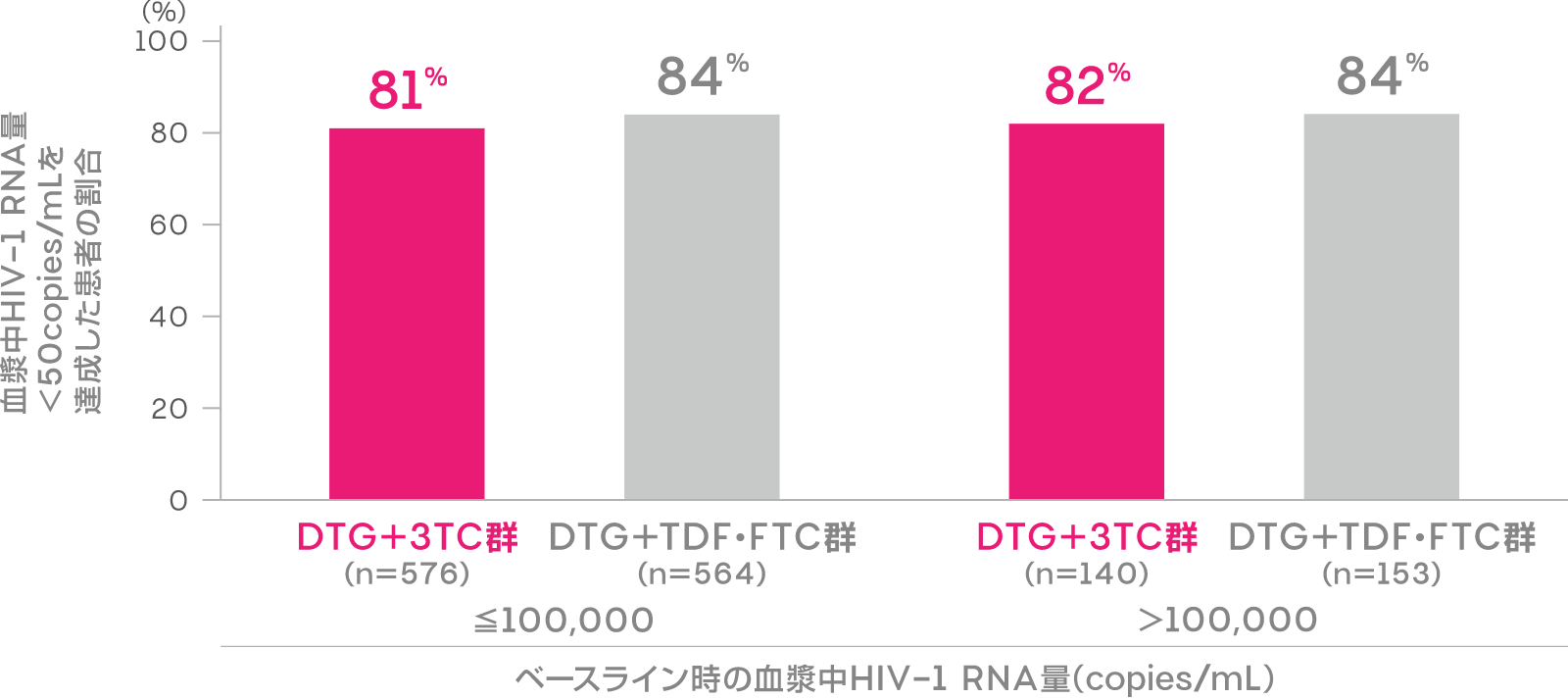
FDA Snapshotアルゴリズム解析
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
CVWが認められた患者における
耐性変異発現
(投与144週)(副次評価項目)
CVWが認められた患者における耐性変異発現(投与144週時)(副次評価項目)
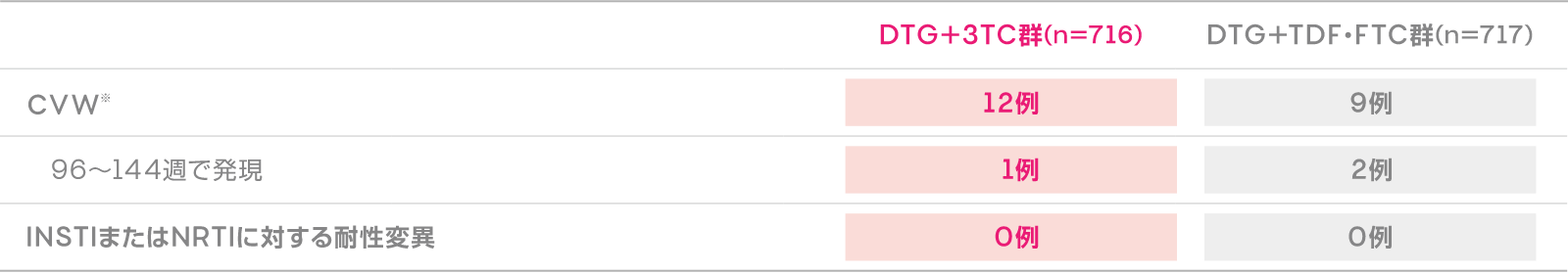
※CVW(Confirmed Virologic Withdrawal)の定義:2回連続してHIV-1 RNA量がウイルス学的無効またはウイルス学的リバウンドに該当した場合。
- ウイルス学的無効:投与12週目までの血漿中HIV-1 RNA量減少が<1 log10 copies/mL(<200copies/mLの場合を除く)、または投与24週目以降に血漿中HIV-1 RNA量≧200copies/mLが検出された場合
- ウイルス学的リバウンド:血漿中HIV-1 RNA量<200copies/mLに至った後に血漿中HIV-1 RNA量≧200copies/mLに再上昇した場合
CVWが認められなかった患者における耐性発現
※投与132週時にM184V、投与144週時にR263R/Kの変異がみられた。投与4~120週時においてHIV-1 RNA量<50copies/mLを達成し、投与132週時にウイルス量が増加(担当医はアドヒアランス不良によるものと判断)したが、4週後に再度抑制されたため、CVW基準は満たさないとされた。投与144週時にウイルス量の低レベルの増加がみられ、投与148週時に効果不十分により試験中止となった。DTGに対するFold Changeは1.8であった。試験中止後、DTG+ダルナビル/コビシスタットを1日1回に切り替え、ウイルス学的抑制が得られた。
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
安全性:副作用発現率
(投与144週)
本試験における投与144週後の副作用発現率は、DTG+3TC群で20%(146/716例)、DTG+TDF・FTC群で27%(192/717例)であり、主な副作用(発現率≧1%)は両群ともに頭痛8例(1%)でした。また、重篤な副作用は、DTG+3TC群で5例(自殺念慮2例、精神障害、物質誘発性精神障害、肝毒性各1例)、DTG+TDF・FTC群で5例(自殺念慮2例、自殺企図、胆石症、横紋筋融解症各1例)に認められました。
副作用発現率(投与144週後)

[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
安全性:有害事象発現率
(投与144週)
本試験における投与144週後の有害事象発現率は、DTG+3TC群で86%(613/716例)、DTG+TDF・FTC群で87%(625/717例)でした。主な有害事象は下表のとおりでした。
死亡は、DTG+3TC群で3例(急性心筋梗塞、バーキットリンパ腫、冠動脈疾患各1例)、DTG+TDF・FTC群で1例(原因不明)に認められましたが、治験薬との因果関係は否定されました。
投与中止に至った有害事象は、DTG+3TC群では31例であり、そのうち投与中止に至った注目すべき有害事象は精神障害が11例、腎関連が2例、DTG+TDF・FTC群では33例であり、投与中止に至った注目すべき有害事象は精神障害が8例、腎関連が12例、骨粗鬆症が2例でした。
重篤な有害事象はDTG+3TC群で76例、 DTG+TDF・FTC群で85例に認められました。主な重篤な有害事象は、DTG+3TC群では自殺企図8例、A型肝炎※16例、肛門性器疣贅4例、肺炎3例、四肢膿瘍、ホジキン病、C型急性肝炎各2例、虫垂炎、蜂巣炎、自然流産、自殺念慮※2各1例、DTG+TDF・FTC群ではA型肝炎※17例、虫垂炎、蜂巣炎、自殺念慮※3各4例、肺炎、肛門性器疣贅、腎結石症、急性胆嚢炎各3例、自殺企図※4、自然流産、痙攣各2例、C型急性肝炎1例でした。
有害事象発現率(投与144週後)
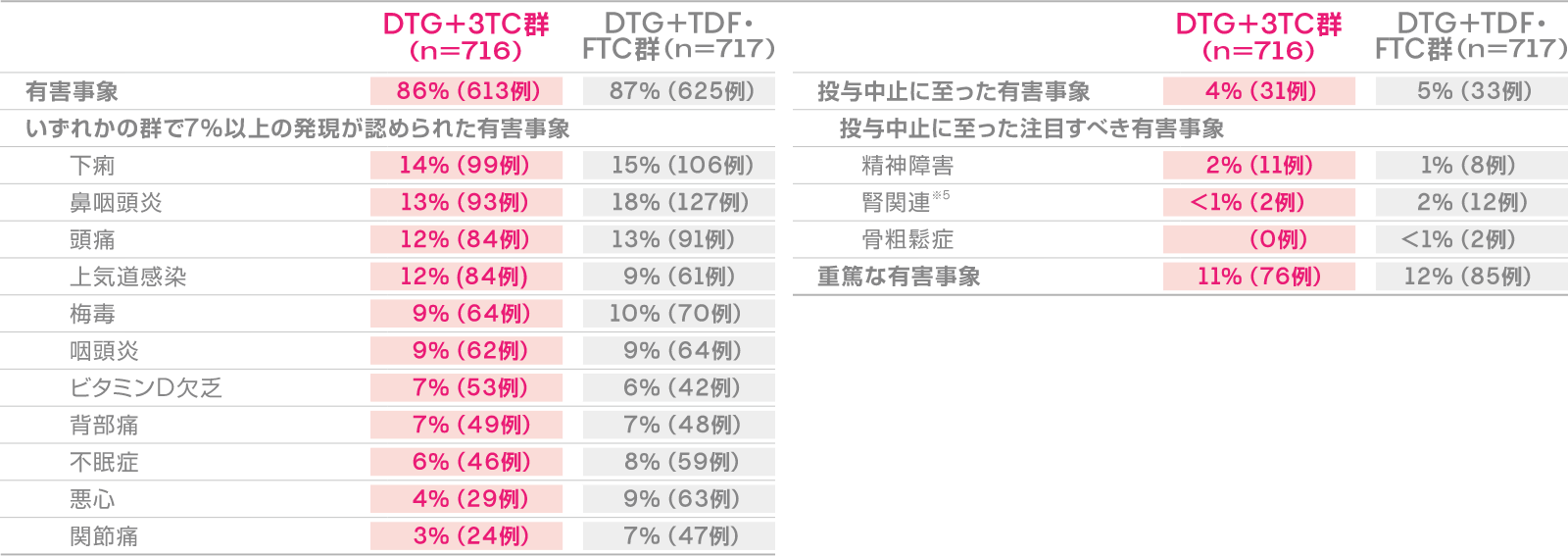
※1 A型肝炎の流行が本試験に参加した欧州各国において同時期に発生していた。
※2 治験薬との因果関係が認められた。
※3 4例中2例は治験薬との因果関係が認められた。
※4 2例中1例は治験薬との因果関係が認められた。
※5 腎機能障害、腎不全、慢性腎臓病、腎尿細管障害、糸球体濾過率の低下、血中クレアチニン増加、クレアチニン腎クリアランス減少を含む
[Cahn P, et al.: AIDS, 36(1), 39-48(2022)]
[社内資料:海外臨床試験〔GEMINI-1(204861)及びGEMINI-2(205543)試験の併合解析〕]
PM-JP-DLL-WCNT-220004 | 作成年月2023年9月

