STAT試験 (第Ⅲb相臨床試験)
海外データ
肝障害または腎障害の既往歴やHBV重複感染がなく、HIV感染症治療による治療経験のない成人HIV-1感染患者を対象とした非盲検単群パイロット試験
試験概要
【目的】
HIV-1感染症と新規に診断された患者において、ドルテグラビル・ラミブジン(DTG・3TC)の診断即治療(test-and-treat)の実施可能性、有効性及び安全性を評価する。
【対象】
肝障害または腎障害の既往歴やHBV重複感染がなく、ARTによる治療経験のない成人HIV-1感染症患者131例(試験組入れ前14日以内にHIV-1感染症と診断された患者)
【方法】
多施設共同、非盲検、単群、パイロット試験
ドウベイト(DTG・3TC:50mg・300mg)を1日1回投与し、投与24週時及び48週時における有効性及び安全性を評価した。治療抵抗性が確認された場合はARTを変更した。ARTを変更した患者及びウイルス学的治療失敗(CVF)※1の基準を満たした患者は試験を継続した。
評価項目
【有効性】
主要評価項目:
投与24週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
副次評価項目:
投与48週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合、ウイルス学的治療アウトカムなど
【安全性】
有害事象、臨床検査値異常など
【解析計画】
主要評価項目の評価についてはITT-E集団※2を用いて、データ欠損はHIV-1 RNA量≧50copies/mLとみなす解析(missing=failure analysis)を行った。投与48週時における主要な副次評価項目の評価については、主要評価項目と同様のmissing=failure analysisのほか、observed analysis※3及びDTG・3TC継続例におけるFDA Snapshot解析を行った。FDA Snapshot解析では、HIV-1 RNA量<50copies/mLで評価時(例;24週、48週の再検査)にDTG・3TCを継続していた場合は「HIV-1 RNA量<50copies/mL」、何らかの理由でDTG・3TCから切り替えた参加者は評価期間内にHIV-1 RNA量<50copies/mLであったかどうかに関わらず「HIV-1 RNA量≧50copies/mL」と分類される。HIV-1 RNA量≧50copies/mLの参加者は「HIV-1 RNA量≧50copies/mL」と分類される。評価期間より前に投与を中止した参加者は中止の理由によって、「HIV-1 RNA量≧50copies/mL」または「ウイルス学的データなし」と分類される。また、副次評価項目である血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合については、ベースライン時の血漿中HIV-1 RNA量別、CD4陽性リンパ球数別にサブグループ解析を実施した。
ART:抗レトロウイルス療法
※1 CVF(confirmed virologic failure)の定義:ウイルス学的無効〔投与8週目までの血漿中HIV-1 RNA量減少が<2.0 log10 copies/mL(<200copies/mLの場合を除く)、投与12週目に血漿中HIV-1 RNA量≧1000copies/mL、または投与24週目以降に血漿中HIV-1 RNA量≧200copies/mLが検出された場合)またはウイルス学的リバウンド(血漿中HIV-1 RNA量<200copies/mLに至った後に血漿中HIV-1 RNA量≧200copies/mLに再上昇した場合)が認められた場合。
※2 1回以上DTG・3TCを投与された集団
※3 投与48週時においてHIV-1 RNA量のデータが得られた患者のうち、HIV-1 RNA量<50copies/mLを維持した患者の割合
[Rolle CP, et al.: AIDS, 35(12), 1957-1965(2021)]
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
試験デザイン
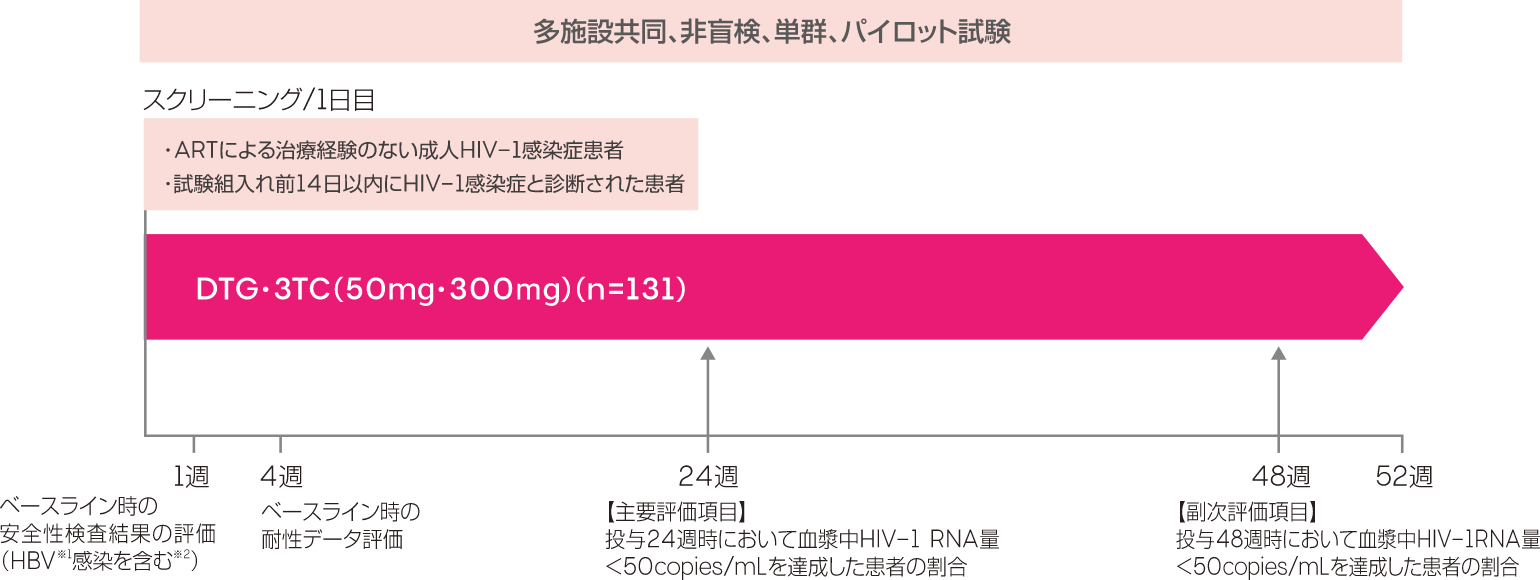
- スクリーニング/ベースライン時の検査結果が得られる前に、14日以内にHIV-1感染症と診断された患者がDTG・3TCの投与を開始した。
- ベースライン時の検査でHBV※1感染、DTGまたは3TCへの遺伝子型に基づく耐性、またはクレアチニンクリアランス<30mL/min/1.73m2が確認された場合、または試験期間中に必要に応じて治療を変更した。
- 治療を変更した患者は試験を継続した。
ART : 抗レトロウイルス療法
※1 B型肝炎ウイルス
※2 HBV非感染の定義:スクリーニング時のHBV HBs抗原、抗HBc抗体、抗HBs抗体、HBV DNA検査結果に基づきHBV感染症と考えられる以下の者を除外した患者
- HBs抗原陽性者
- 抗HBs抗体陰性で抗HBc抗体陽性(HBs抗原陰性)かつHBV DNA陽性者
注:抗HBc抗体陽性(HBs抗原陰性)かつ抗HBs抗体陽性者(過去及び/または現在の感染を示す)はHBVに対する免疫があり、除外しない。
[Rolle CP, et al.: AIDS, 35(12), 1957-1965(2021)]
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
患者背景
患者背景(ITT-E集団)
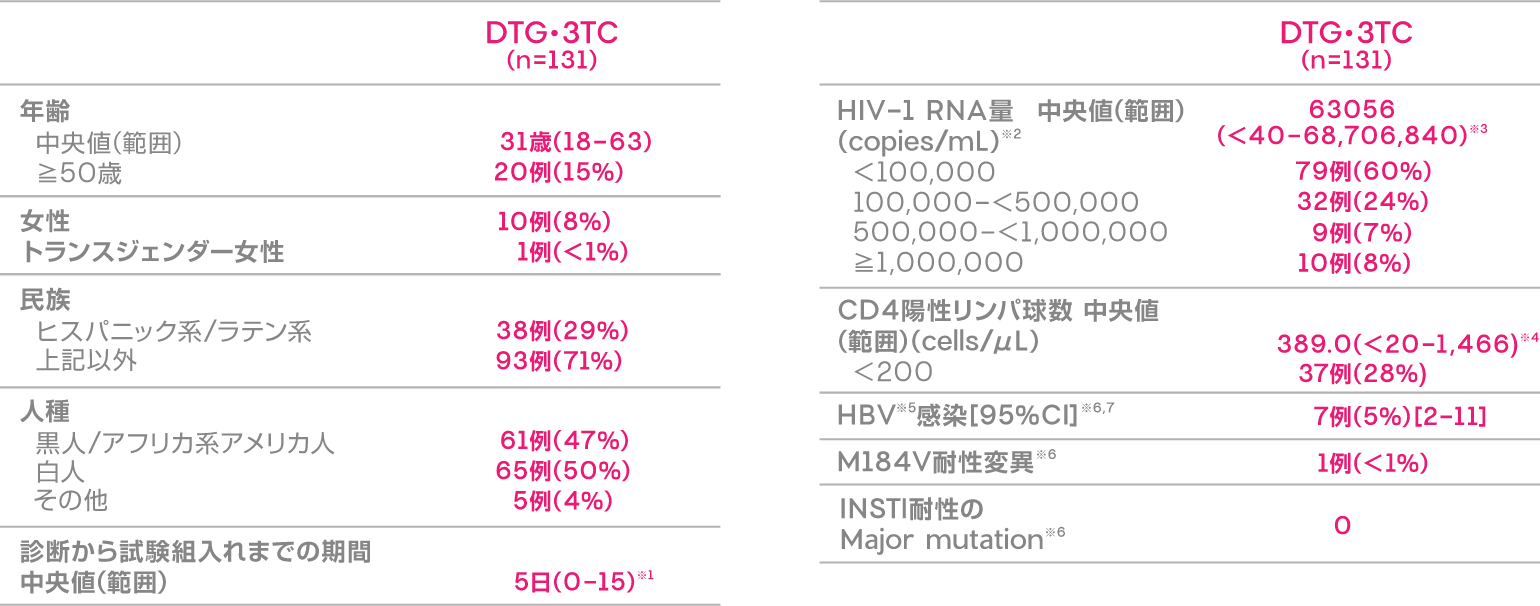
※1 1例は診断から15日後に試験に参加した(組入れ基準:診断後14日以内)。
※2 1例(<1%)はベースライン時の血漿HIV-1 RNAデータ欠測
※3 定量下限値<40
※4 定量下限値<20
※5 B型肝炎ウイルス
※6 ベースライン時の耐性は4週目に、HBV感染は1週目に、ベースライン時に採取したサンプルから同定した。
ベースライン時に耐性が確認された患者は8週目にDTG・3TCから治療を変更した。
※7 2例のHBV感染者はHBV DNA検査が定量的でなく、またHBV複製が活発である証拠がなかったため、DTG・3TCを継続した。
[Rolle CP, et al.: AIDS, 35(12), 1957-1965(2021)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
抗ウイルス効果
(主要及び副次評価項目)
【主要評価項目】
投与24週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は78%(102/131例)でした(ITT-E missing=failure analysis)※1。
【副次評価項目】
投与48週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は以下のとおりでした。
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合(投与48週時)(副次評価項目)
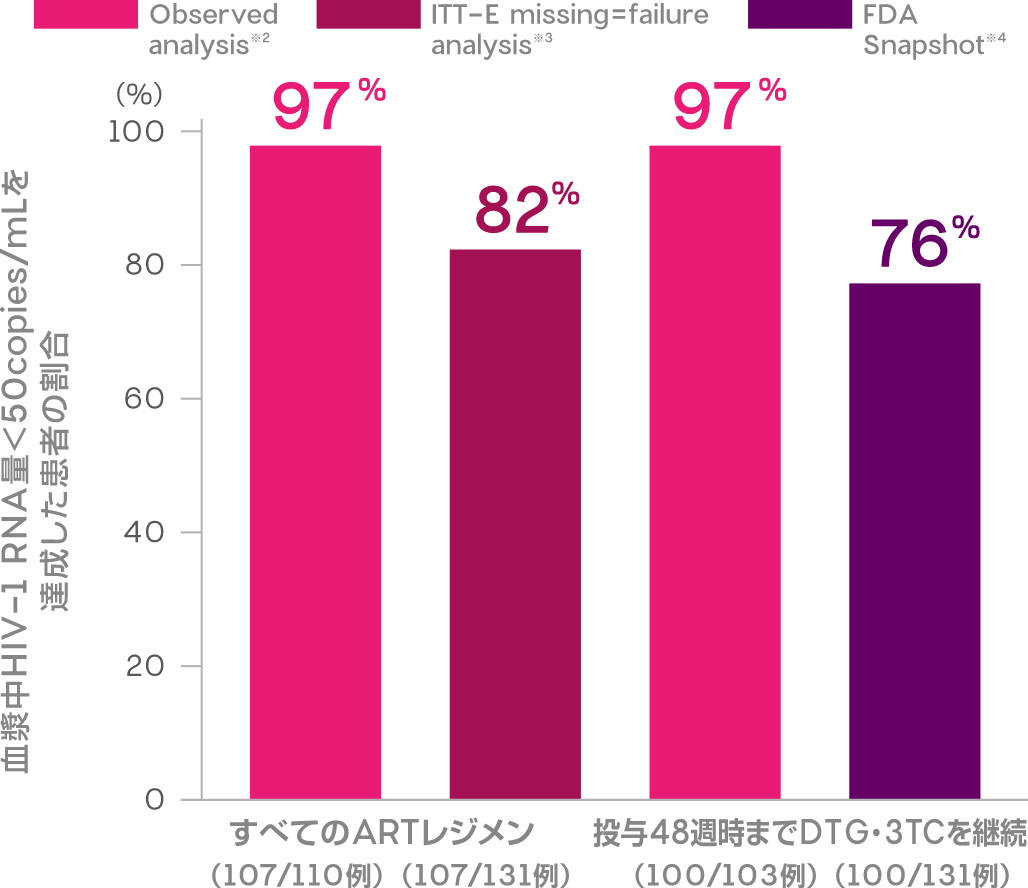
ウイルス学的治療アウトカム:FDA Snapshot解析(投与48週時)(副次評価項目)

注:4週時点で、ベースライン時のM184V耐性変異が確認された患者は8週目にDTG・3TCから治療を変更したため、解析対象には含まれていない。
※1 投与24週以前にARTを変更した5例を含む
※2 投与48週時においてHIV-1 RNA量のデータが得られた患者のうち、HIV-1 RNA量<50copies/mLを維持した患者の割合
※3 すべての患者のうち、投与48週時においてHIV-1 RNA量<50copies/mLを維持した患者の割合(データ欠測はHIV-1 RNA量≧50copies/mLとみなす)
※4 すべての患者のうち、投与48週時においてHIV-1 RNA量<50copies/mLを維持し、かつ、DTG・3TCを継続投与していた患者の割合
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
ベースライン時の血漿中HIV-1 RNA量別 抗ウイルス効果
(副次評価項目:サブグループ解析)
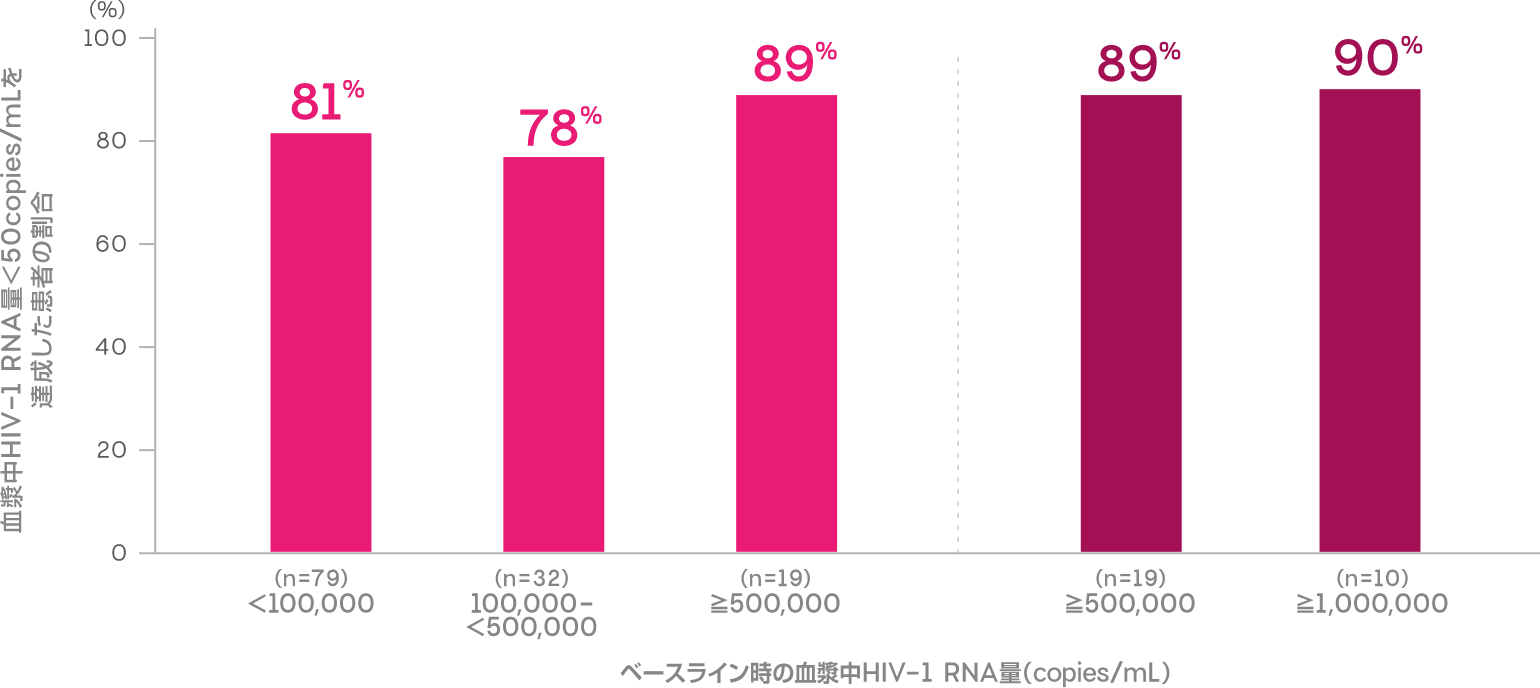
ベースライン時の血漿中HIV-1 RNA量別(<100,000、100,000-<500,000、≧500,000copies/mL)に解析した投与48週時において血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は以下のとおりでした。
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合 (投与48週時)(副次評価項目:サブグループ解析)
ITT-E missing=failure analysis
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
ベースライン時のCD4陽性リンパ球数別 抗ウイルス効果
(副次評価項目:サブグループ解析)
CD4陽性リンパ球数別(≧200、<200cells/mm3)に解析した投与48週時において、血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合は以下のとおりでした。
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合 (投与48週時)(副次評価項目:サブグループ解析)
ITT-E missing=failure analysis
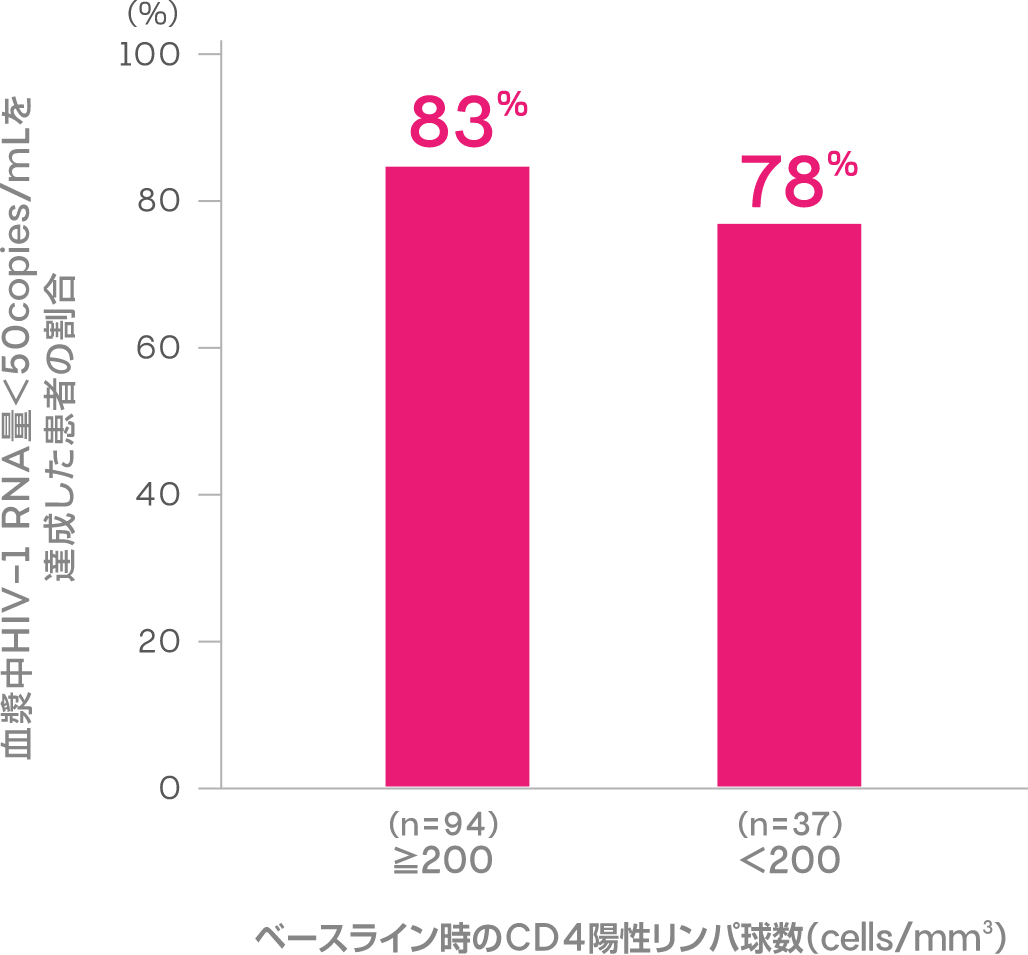
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
安全性
本試験における投与48週後の有害事象発現率は76%(100/131例)であり、主な有害事象(発現率≧7%)は下表のとおりでした。 副作用発現率は8%(10/131例)であり、主な副作用(発現例数≧2例)は下痢、悪心、発疹、頭痛が各2例でした。
投与中止に至った有害事象は1例(グレード1の発疹)に認められました。重篤な有害事象は2例に認められ、その内訳は蜂巣炎、溶血性連鎖球菌菌血症が各1例(薬剤と関連なし)でした。本試験期間中に死亡は認められませんでした。
有害事象発現率 (投与48週後)
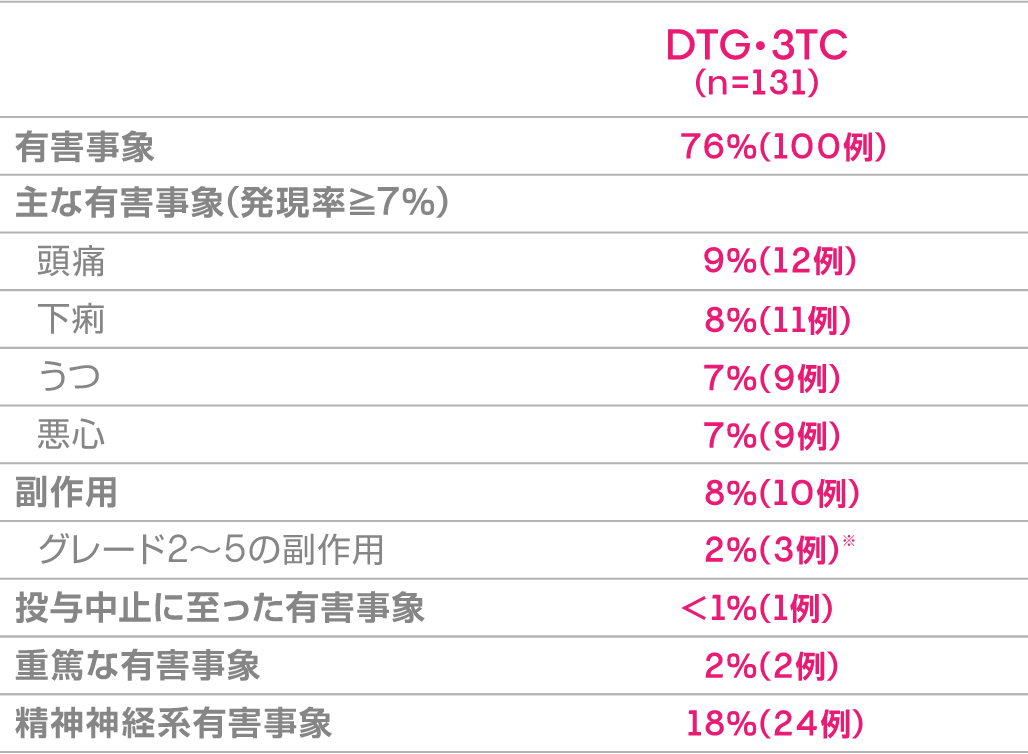
※すべてグレード2
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
STAT試験 LImItatIon
本試験は米国における診断即治療(test-and-treat)方式でDTG・3TCを評価しており、HIV負荷が大きく、伝播性薬剤耐性変異保有率やHBVの共感染率が高く、医療資源の少ない他地域では、結果が一般化できない可能性がある。また単群、非比較試験という試験デザインによっても一般化が制限される可能性がある。
[Rolle CP, et al.: Open Forum Infect Dis, 10(3), ofad101(2023)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。
著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。
また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクラインの社員や株を有する者が含まれる。]
PM-JP-DLL-WCNT-220004 | 作成年月2023年9月

