海外データ
ウイルス学的抑制が得られている成人HIV感染症患者を対象とした非盲検比較検証試験(非劣性試験)
【目的】
ウイルス学的抑制が得られている成人HIV-1感染症患者において、テノホビル アラフェナミド(TAF)をベースとした3~4剤併用レジメン※1からドルテグラビル・ラミブジン(DTG・3TC)へ切り替えた場合の有効性を検証するとともに、安全性、忍容性を評価する。
【対象】
ウイルス学的抑制が得られている成人HIV-1感染症患者741例[ウイルス学的治療失敗(血漿中HIV-1 RNA量≧400copies/mL)がない、スクリーニング前6ヵ月超の血漿中HIV-1 RNA量が50copies/mL未満、TAFをベースとした3~4剤併用レジメンを使用]
【方法】
多施設共同、無作為化、非盲検、実薬対照、並行群間比較検証試験(非劣性試験)
対象患者を、ドウベイト(DTG・3TC:50mg・300mg)を1日1回投与するDTG・3TC Switch群と現在のTAFをベースとしたレジメンを継続投与したTAF継続群の2群に無作為に割り付けた。投与48週時及び144週時の有効性について、TAF継続群に対するDTG・3TC Switch群の非劣性を検証(投与48週時)ならびに検討(投与144週時)するとともに、投与48週時及び144週時の安全性及び忍容性についても評価した。また、TAF継続群のうち、144週時にウイルス学的抑制(血漿中HIV-1 RNA量が50copies/mL未満)が得られた患者は、148週目にDTG・3TCへ切り替えた。無作為化時にDTG・3TC Switch群に割り付けられた群をDTG・3TC 早期Switch群、投与148週時にDTG・3TCへ切り替えた群をDTG・3TC 後期Switch群とし、196週時の有効性及び安全性をそれぞれ検討した。
評価項目
【有効性】
主要評価項目(検証的な解析項目):
投与48週時における血漿中HIV-1 RNA量≧50copies/mLであった患者の割合※2
副次評価項目:
投与144週時における血漿中HIV-1 RNA量≧50copies/mLであった患者の割合※2、投与48週時及び144週時における血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合※2、ウイルス学的治療アウトカム、投与48週時及び144週時におけるベースライン時からのCD4陽性リンパ球数の変化量
ウイルス学的エンドポイント:投与48週時及び144週時における耐性変異の発現 など
探索的評価項目:
投与48週時におけるベースライン時のCD4陽性リンパ球数/使用薬剤別抗ウイルス効果※2、投与196週時における血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合、投与196週時におけるベースライン時からのCD4陽性リンパ球数の変化量、ウイルス学的エンドポイント:投与196週時における耐性変異の発現 など
ヘルスアウトカムエンドポイント:QOLへの影響[EQ-5D-5L Utilityスコア(ベースラインからの変化量)]など
ヘルスアウトカムエンドポイント:
QOLへの影響[EQ-5D-5L Utilityスコア(ベースライン時からの変化量)]など
【安全性】
有害事象発現率、腎機能(腎血清マーカー:クレアチニンによるeGFR、シスタチンCによるeGFR、尿マーカー:蛋白/クレアチニン比、レチノール結合蛋白/クレアチニン比、β2-ミクログロブリン/クレアチニン比)、骨(骨代謝マーカー:血清骨型アルカリフォスファターゼ、血清オステオカルシン、血清Ⅰ型プロコラーゲンN-末端プロペプチド、血清Ⅰ型コラーゲンC-テロペプチド)、脂質(脂質代謝マーカー:総コレステロール、HDL・LDLコレステロール、トリグリセリド、総コレステロール/HDLコレステロール比)、糖代謝(HOMA-IR)、体重への影響 など
【解析計画】
投与48週時及び144週時の有効性(主要及び副次評価項目)については、非劣性マージンを4%(血漿中HIV-1 RNA量≧50copies/mLであった患者の割合)及び-8%(血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合)とし、TAF継続群に対するDTG・3TC Switch群の非劣性を検証(主要評価)及び検討(副次評価)した。なお、両群の奏効率※3は、FDA Snapshotアルゴリズム解析によって算出し、両群間の奏効率の差は、Cochran-Mantel-Haenszel検定を用いた層別解析に基づいて調整後、算出した。主要及び副次評価項目の評価についてはITT-E集団※4を用いてFDA Snapshotアルゴリズム解析によって評価したが、主要及び副次評価項目の感度分析にはper-protocol集団※5を用いた。また、主要評価項目について、事前に規定されているサブグループ(ベースライン時のCD4陽性リンパ球数、使用薬剤)別の解析を行った。さらに、2回連続して血漿中HIV-1 RNA量≧50copies/mL(2回目は血漿中HIV-1 RNA量≧200copies/mL)が検出された場合をCVW※6とプロトコールで規定し、投与48週時及び144週時(副次評価項目)、196週時(探索的評価項目)にCVWが認められた患者における耐性変異の発現を検討した。196週時の有効性(血漿中HIV-1 RNA量<50copies/mLであった患者の割合) (探索的評価項目)はITT-E集団※4を用いてFDA Snapshotアルゴリズム解析によって算出した。腎機能(腎血清マーカー、尿マーカー)への影響については、治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、糖尿病及び高血圧の既往、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM※7を用いて解析した。骨(骨代謝マーカー)への影響については、治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、ビタミンD製剤使用有無、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したrepeated measures modelを用いて解析した。また、脂質(脂質代謝マーカー)への影響については、投与48週時は治療、来院、ベースライン時の使用薬剤、 CD4陽性リンパ球数、対数変換したベースライン時の空腹時脂質値、治療と来院の相互関係及びベースライン時の空腹時脂質値と来院の相互関係を調整し、来院を反復因子として調整したrepeated measures modelを用いて算出し、欠測値はLOCF※8を用いて補完し、144週時は治療、来院、ベースライン時の使用薬剤、年齢、BMI、人種、CD4陽性リンパ球数、対数変換したベースライン時の値、治療と来院の相互関係、ベースライン値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRMを用いて算出した。糖代謝(インスリン抵抗性)への影響については、投与48週時は治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、高血圧の既往、対数変換したベースライン時のHOMA-IR値、治療と来院の相互関係及びベースライン時のHOMA-IR値と来院の相互関係を調整し、来院を反復因子として調整したrepeated measures modelを用いて解析し、144週時は治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、高血圧の既往、対数変換したベースライン時のHOMA-IR値、治療と来院の相互関係、ベースライン時の値と来院の相互関係を調整し、来院を反復因子として調整したMMRMを用いて算出した。体重への影響については、投与144週時は治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、前治療のTAF投与期間、地域、BMIサブグループ、治療と来院の相互関係で調整し、治療とBMIサブグループの相互関係、BMIサブグループと来院の相互関係、治療、BMIサブグループと来院の相互関係、来院を反復因子として調整したMMRMを用いて解析した。炎症マーカーへの影響については、ベースライン時及び144週時の実測値を幾何平均値として示した。196週時の各種バイオマーカー及び体重への影響は実測値または対数変換値の幾何平均比で示した。
※1 スクリーニングの3ヵ月以上前にテノホビル ジソプロキシルフマル酸塩(TDF)からTAFにSwitchした場合は可とした
※2 ITT-E集団におけるFDA Snapshotアルゴリズム解析を実施(層別解析にはCochran-Mantel-Haenszel検定を用いた)
※3 血漿中HIV-1 RNA量≧50copies/mLであった患者の割合
※4 ITT-E集団:無作為化され、1回以上治験薬を投与された集団
※5 per-protocol集団:ITT-E集団からプロトコール逸脱例を除外した集団
※6 CVW:Confirmed Virologic Withdrawal
※7 MMRM:Mixed Model Repeated Measures
※8 LOCF:Last Observation Carried Forward
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)を支援した者、ヴィーブヘルスケア(株)が過去に、謝礼、講演料、研究費等を支払った者が含まれる。また、著者にはヴィーブヘルスケア(株)の社員が含まれる。]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクライン(株)の社員や株を有する者が含まれる。]
[Wang R, et al.: Open Forum Infect Dis., 11(1): ofad626(2024)]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクライン(株)の社員や株を有する者が含まれる。]
[De Wit S, et al.: J Acquir Immune Defic Syndr., 2024 Mar 1. Online ahead of print.]
[本試験に関する費用は、ヴィーブヘルスケア(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)が過去に、謝礼、補助金、ノンフィナンシャルサポート等を支払った者が含まれる。また、著者にはヴィーブヘルスケア(株)の社員及びグラクソ・スミスクライン(株)の社員や株を有する者が含まれる。]
[ClinicalTrials.gov https://clinicaltrials.gov/study/NCT03446573(2024年4月閲覧)]
※1 スクリーニングの3ヵ月以上前にテノホビル ジソプロキシルフマル酸塩(TDF)からTAFにSwitchした場合は可とした
※2 B型肝炎ウイルス
※3 TAF継続群のうち、144週時にウイルス学的抑制(血漿中HIV-1 RNA量が50copies/mL未満)が得られた患者
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
[Wang R, et al.: Open Forum Infect Dis., 11(1): ofad626(2024)]
[De Wit S, et al.: J Acquir Immune Defic Syndr., 2024 Mar 1. Online ahead of print.]
[ClinicalTrials.gov https://clinicaltrials.gov/study/NCT03446573(2024年4月閲覧)]
患者背景①
患者背景(ITT-E集団)
[添付文書改訂時の評価資料:海外臨床試験(204862)]
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
患者背景②
患者背景(ITT-E集団)
ART:抗レトロウイルス療法、bDRV:ブーストされたダルナビル、DTG:ドルテグラビル、EVG/c:エルビテグラビル/コビシスタット、FTC:エムトリシタビン、INSTI:インテグラーゼ阻害薬、NNRTI:非核酸系逆転写酵素阻害薬、PI:プロテアーゼ阻害薬、RPV:リルピビリン、TAF:テノホビル アラフェナミド、3TC:ラミブジン
[添付文書改訂時の評価資料:海外臨床試験(204862)]
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
患者背景③
患者背景(ITT-E集団)
注:DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
患者背景④
患者背景(ITT-E集団)
ART:抗レトロウイルス療法、bDRV:ブーストされたダルナビル、DTG:ドルテグラビル、EVG/c:エルビテグラビル/コビシスタット、FTC:エムトリシタビン、INSTI:インテグラーゼ阻害薬、NNRTI:非核酸系逆転写酵素阻害薬、PI:プロテアーゼ阻害薬、RPV:リルピビリン、TAF:テノホビル アラフェナミド、3TC:ラミブジン
※DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
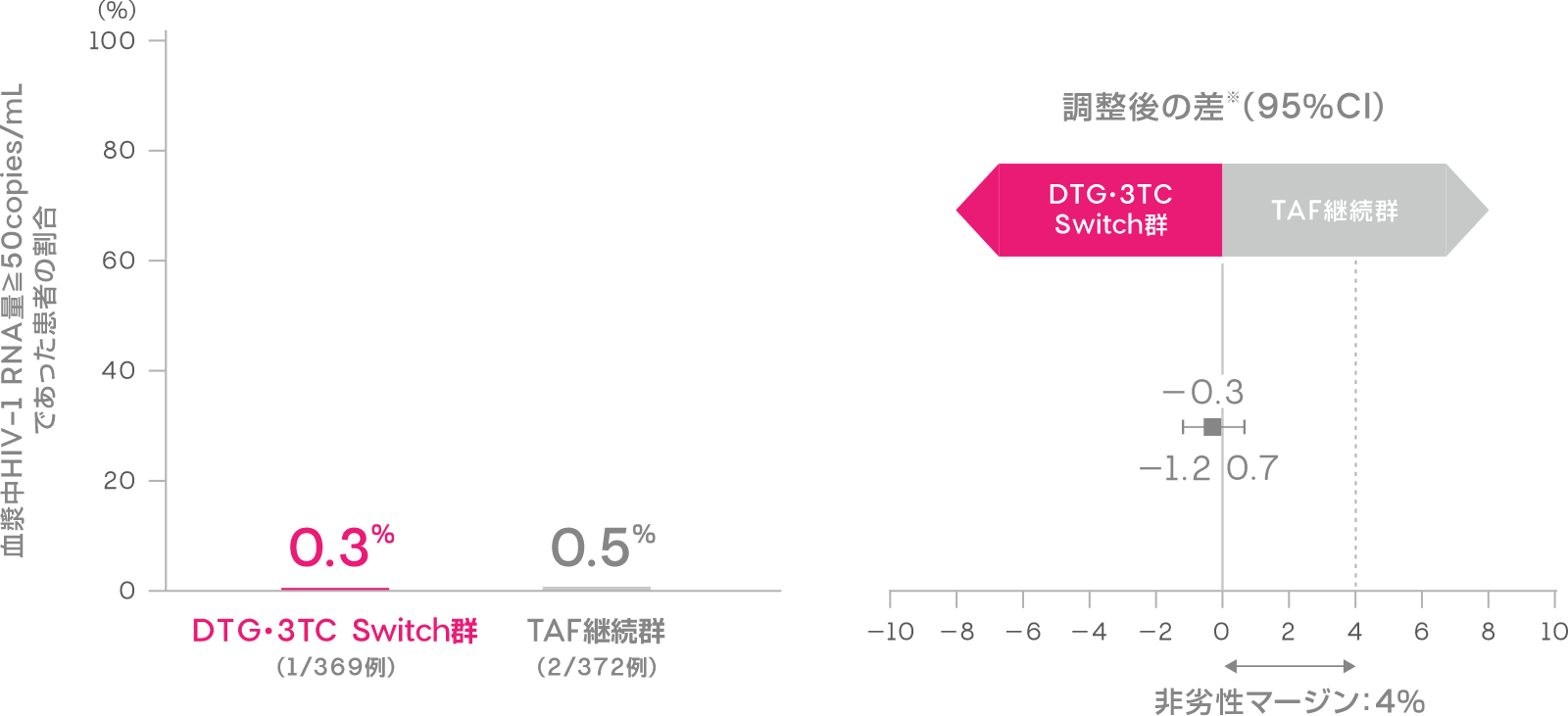
投与48週時において血漿中HIV-1 RNA量≧50copies/mLであった患者の割合は、DTG・3TC Switch群で0.3%(1/369例)、TAF継続群で0.5%(2/372例)であり、TAF継続群に対するDTG・3TC Switch群の非劣性が検証されました[調整後の差※:-0.3%(95%CI:-1.2,0.7):ITT-E集団]。
血漿中HIV-1 RNA量≧50copies/mLであった患者の割合
(投与48週時、ITT-E集団)(主要評価項目:検証的な解析結果)
FDA Snapshotアルゴリズム解析|
※Cochran-Mantel-Haenszel weightを用いた層別解析に基づく調整済みの差 (非劣性マージン:4%)
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
抗ウイルス効果
(投与144週)(副次評価項目)
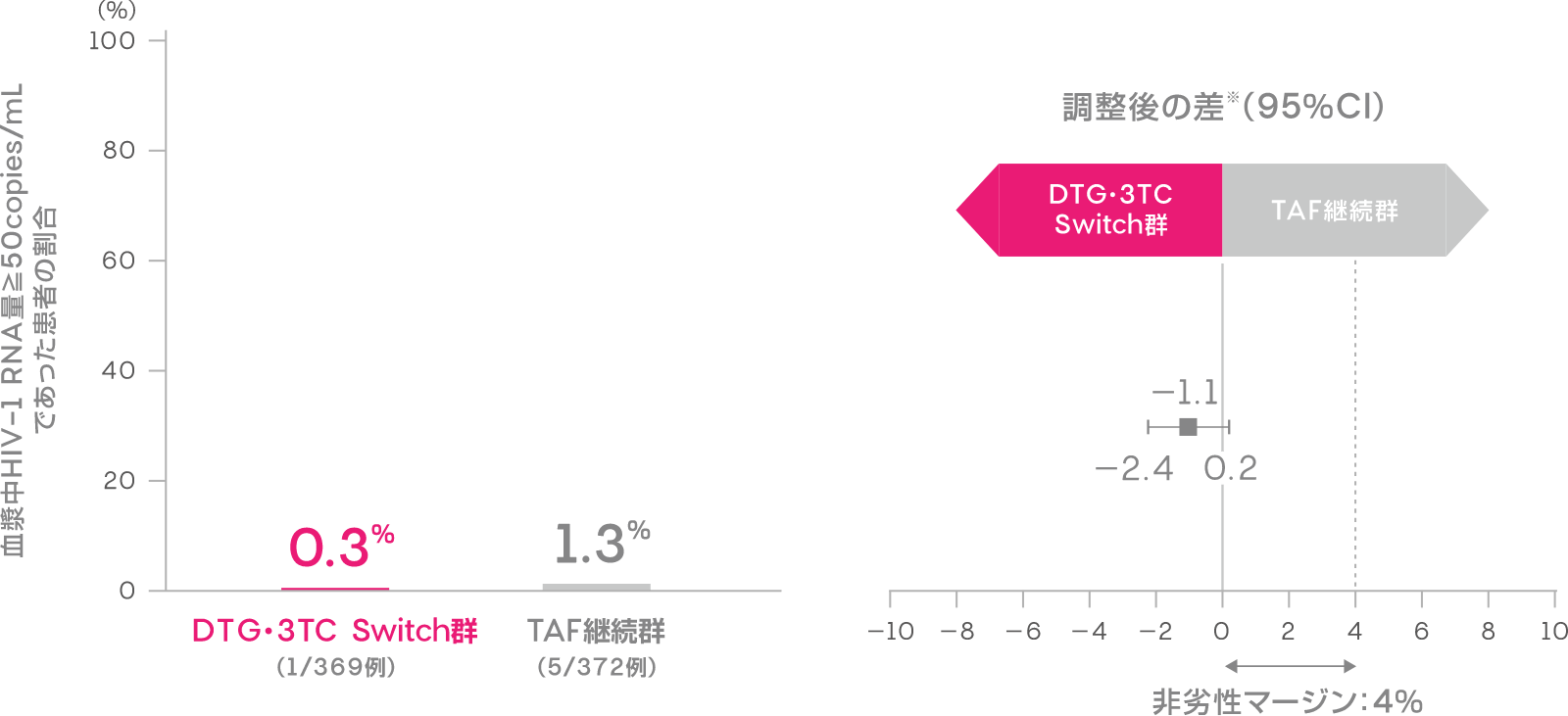
投与144週時において血漿中HIV-1 RNA量≧50copies/mLであった患者の割合は、DTG・3TC Switch群で0.3%(1/369例)、TAF継続群で1.3%(5/372例)でした[調整後の差※:-1.1%(95%CI:-2.4, 0.2):ITT-E集団]。
血漿中HIV-1 RNA量≧50copies/mLであった患者の割合
(投与144週時、ITT-E集団)(副次評価項目)
FDA Snapshotアルゴリズム解析
※Cochran-Mantel-Haenszel weightを用いた層別解析に基づく調整済みの差 (非劣性マージン:4%)
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
抗ウイルス効果
(投与144週)(副次評価項目)
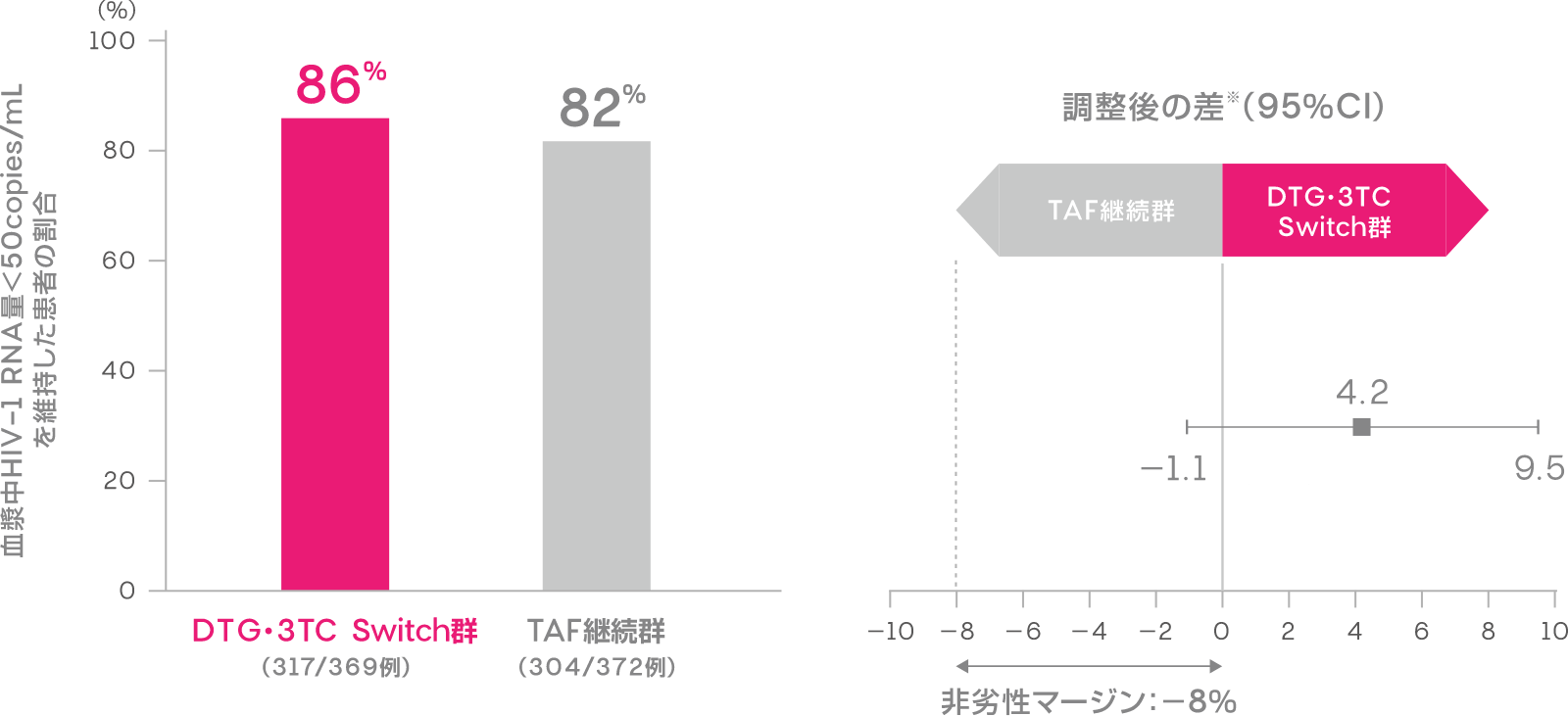
投与144週時において血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合は、DTG・3TC Switch群で86%(317/369例)、TAF継続群で82%(304/372例)でした[調整後の差※:4.2%(95%CI:-1.1, 9.5):ITT-E集団]。
血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合
(投与144週時、ITT-E集団)(副次評価項目)
FDA Snapshotアルゴリズム解析
※Cochran-Mantel-Haenszel weightを用いた層別解析に基づく調整済みの差(非劣性マージン:-8%)
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
抗ウイルス効果
(投与196週)(副次評価項目、探索的評価項目)
投与196週時において血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合は、DTG・3TC 早期Switch群が83%(306/369例)、DTG・3TC 後期Switch群が93%(278/298例)でした。
血漿中HIV-1 RNA量<50copies/mLを維持した患者の割合
(投与196週)(探索的評価項目)
FDA Snapshotアルゴリズム解析
※副次評価項目
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
耐性変異の発現
(投与144週)(副次評価項目)
投与144週時において、DTG・3TC Switch群では耐性変異の発現は認められませんでした。
抗レトロウイルス療法による治療経験のあるHIV感染症患者における耐性発現

CVWが認められた患者における耐性変異発現(投与144週時)(副次評価項目)

※CVW(Confirmed Virologic Withdrawal)の定義:2回連続して血漿中HIV-1 RNA量≧50copies/mL(2回目は血漿中HIV-1RNA量≧200copies/mL)が検出された場合。
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
耐性変異の発現
(投与196週)(探索的評価項目)
投与196週時において、DTG・3TC 早期Switch群およびDTG・3TC 後期Switch群ともに耐性変異の発現は認められませんでした。
抗レトロウイルス療法による治療経験のあるHIV感染症患者における耐性発現

CVWが認められた患者における耐性変異発現(投与196週時)(探索的評価項目)

※CVW(Confirmed Virologic Withdrawal)の定義:2回連続して血漿中HIV-1 RNA量≧50copies/mL(2回目は血漿中HIV-1 RNA量≧200copies/mL)が検出された場合。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
本試験における投与144週後の有害事象発現率は、DTG・3TC Switch群で91%(336/369例)、TAF継続群で90%(335/371例)でした。主な有害事象(いずれかの群における発現率≧10%)は下表のとおりでした。 副作用発現率は、DTG・3TC Switch群で15%(55/369例)、TAF継続群で5%(18/371例)でした。
死亡は、DTG・3TC Switch群で3例[銃創(他殺)(薬剤と関連なし)、薬物乱用(急性中毒)(薬剤と関連なし)、虚血性肝炎(薬剤と関連なし)(各1例)]に認められました。また、投与中止に至った有害事象は、DTG・3TC Switch群では23例であり、その内訳はうつ、不安、不眠症が各3例、体重増加、疲労、自殺念慮、ホジキン病が各2例、その他[悪心(薬剤と関連なし)、腹部不快感、胃食道逆流性疾患、口の感覚鈍麻、口の錯感覚、薬物過敏症、銃創(他殺)(薬剤と関連なし)、びまん性大細胞型B細胞性リンパ腫(薬剤と関連なし)、肺腺癌(薬剤と関連なし)、注意力障害、感覚鈍麻、易刺激性、生殖器感覚鈍麻、生殖器錯感覚、そう痒、トランスアミナーゼ増加、バーキットリンパ腫ステージI(薬剤と関連なし)、薬物乱用による死亡、物質乱用(薬剤と関連なし)、虚血性肝炎(薬剤と関連なし)(各1件)]、TAF継続群では7例であり、その内訳はうつ、不安、体重増加各1例、その他[悪心、血管性浮腫、下痢、自殺企図(薬剤と関連なし)、前立腺癌(薬剤と関連なし)、耳鳴、急性腎不全、肺高血圧症(各1件)]でした。重篤な有害事象は、DTG・3TC Switch群で57例、TAF継続群で44例に認められました。なお、144週目までに薬剤関連の重篤な有害事象が2件(DTG・3TC Switch群のトランスアミナーゼ増加、TAF継続群の血管性浮腫)認められました。
有害事象発現率(投与144週後)
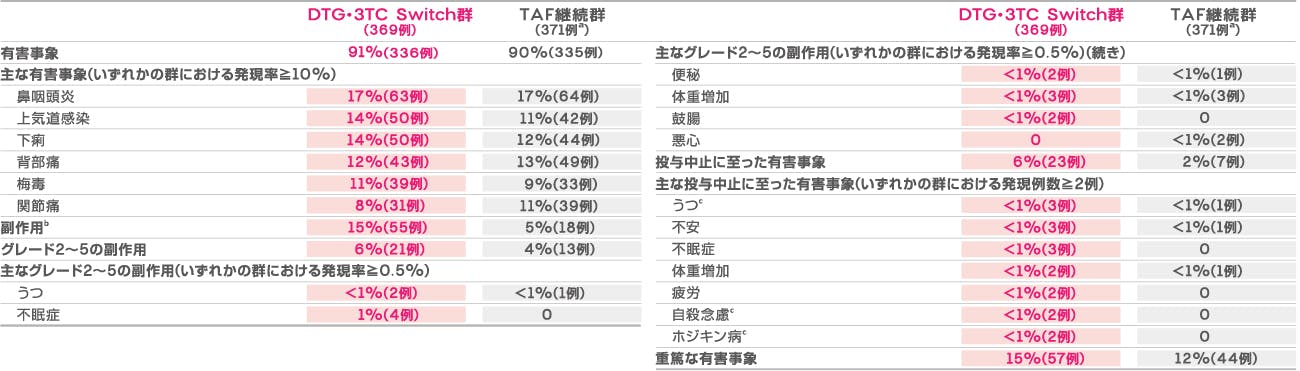
a 1例はTDFベースのレジメンを服用していることが判明し、安全性集団から除外された。
b 96週目までのすべての副作用はグレード1または2であり、144週目までの副作用は、グレード3の事象2件(DTG・3TC Switch群の自殺念慮及びトランスアミナーゼ増加)とグレード4の事象1件(TAF継続群の血管性浮腫)を除き、グレード1または2であった。
c 薬剤と関連なし。うつ病は、DTG・3TC Switch群2例、TAF継続群1例が副作用を経験し、DTG・3TC Switch群1例が有害事象を経験した。自殺念慮は、副作用1例、有害事象1例(いずれもDTG・3TC Switch群)であった。悪心は、144週目では各治療群で1例が副作用を経験し、96週目では1例が副作用、1例が有害事象を経験した(いずれもDTG・3TC Switch群)。
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
安全性
(投与196週)
本試験での投与196週後の有害事象発現率は、DTG・3TC早期Switch群が94%(347/369例)、DTG・3TC後期Switch群が80%(239/298例)でした。主な有害事象(いずれかの投与群の発現率≧10%)は下表の通りでした。薬剤関連の重篤な有害事象は、196週目までに2例(DTG・3TC早期Switch群のトランスアミナーゼ増加、DTG・3TC後期Switch群のI型アレルギー各1件)に認められました。薬剤関連の投与中止に至った有害事象は、後期Switch群では、148週から196週目までの間に6例(情緒障害、無力症、不眠症、下痢、接触性皮膚炎、上腹部痛、不安症各1件、抑うつ2件)に認められました。DTG・3TC早期Switch群では、148週から196週目までの間に投与中止に至った有害事象が2例(肺扁平上皮癌、急性心筋梗塞各1件)に認められ、いずれも薬剤との関連はないと判断されました。死亡に至った有害事象は、196週目までにDTG・3TC 早期Switch群の4例[銃創(他殺)、薬物乱用、虚血性肝炎、急性心筋梗塞各1件]に認められ、いずれも薬剤との関連はないと判断されました。
有害事象発現率(投与196週)※1)

※1 無作為化時にDTG・3TC Switch群に割り付けた群をDTG・3TC早期Switch群、投与148週時にDTG・3TCへ切り替えた群をDTG・3TC後期Switch群とし、196週時の有効性及び安全性をそれぞれ検討した。※2 1日目~196週目までのDTG・3TC 早期Switch群の10%以上に報告された有害事象に基づく。
[社内資料]
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
腎機能への影響
(投与144週)(安全性評価項目)
投与144週時におけるDTG・3TC Switch群及びTAF継続群の腎機能関連マーカーのベースライン時からの変化(調整平均値※1)を下記に示します。
ベースライン時からの腎機能関連マーカーの変化(投与144週時、安全性解析対象集団)(安全性評価項目)
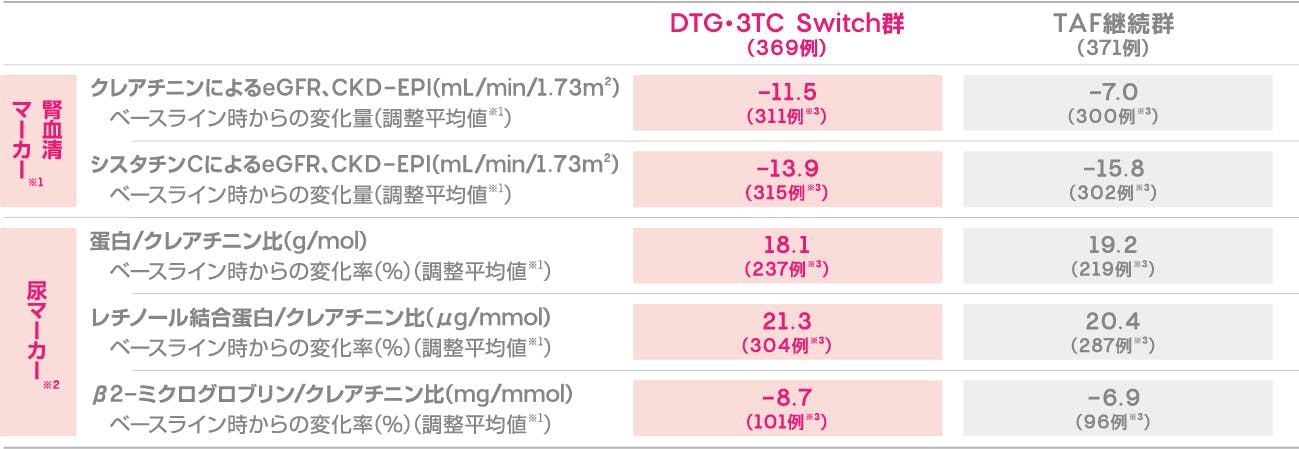
※1 各群のベースラインからの推定平均変化量は、治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、糖尿病及び高血圧の既往、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 推定幾何平均比対ベースライン比に基づく。ベースラインのバイオマーカーを対数変換したものを調整する以外は、腎血清マーカーと同様のモデルに基づく。
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
腎機能への影響
(投与196週)(安全性評価項目)
投与196週時におけるDTG・3TC 早期Switch群及びDTG・3TC後期Switch群の腎機能関連マーカーのベースライン時からの変化(平均変化量または幾何平均比)を以下に示します。
ベースライン時からの腎機能関連マーカーの変化
(投与196週時、安全性解析対象集団)(安全性評価項目)
※1 DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
※2 対数変換値の幾何平均比で示す。
※3 ベースライン時及び196週時のデータがある患者。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
骨への影響
(投与144週)(安全性評価項目)
投与144週時におけるDTG・3TC Switch群及びTAF継続群の骨代謝マーカーのベースライン時からの変化(調整平均値※)を下記に示します。
ベースライン時からの骨代謝マーカーの変化量(投与144週時、安全性解析対象集団)(安全性評価項目)
※1 各群のベースラインからの推定平均変化量は、治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、喫煙状況、ビタミンD製剤使用有無、ベースライン時のバイオマーカー値、治療と来院の相互関係及びベースライン時のバイオマーカー値と来院の相互関係を調整し、来院を反復因子として調整したrepeated measures modelを用いて算出した。
※2 ベースライン時及び144週時のデータがある患者。
骨への影響
(投与196週)(安全性評価項目)
投与196週時におけるDTG・3TC 早期Switch群及びDTG・3TC後期Switch群の骨代謝マーカーのベースライン時からの変化(平均変化量)を以下に示します。
ベースライン時からの骨代謝マーカーの変化
(投与196週時、安全性解析対象集団)(安全性評価項目)
※1 DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
※2 ベースライン時及び196週時のデータがある患者。
脂質への影響
(投与144週)(安全性評価項目)
投与144週時におけるDTG・3TC Switch群及びTAF継続群の空腹時脂質のベースライン時からの変化(調整平均値※1)を下記に示します。
ベースライン時からの空腹時脂質の変化率(投与144週時、安全性解析対象集団)(安全性評価項目)
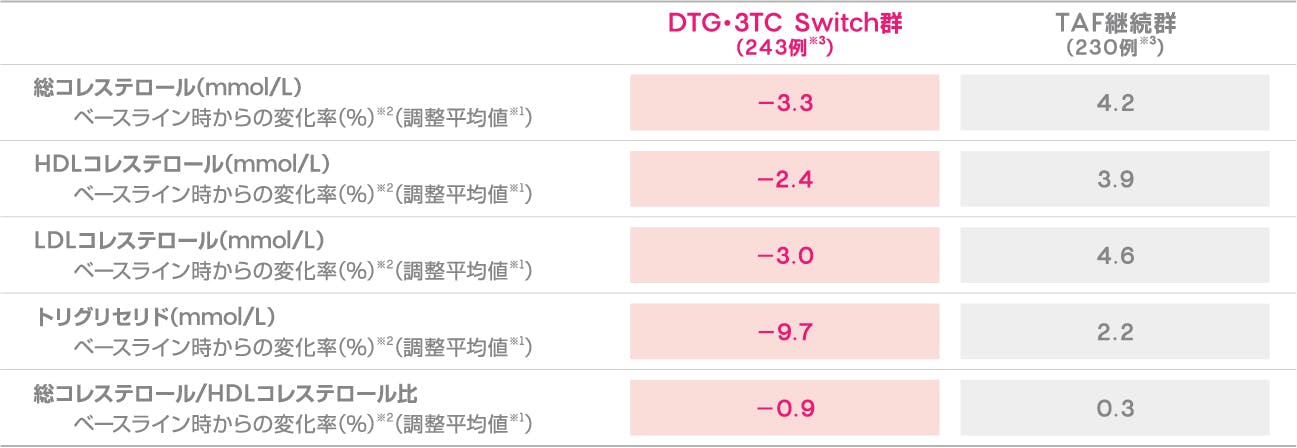
※1 治療、来院、ベースライン時の使用薬剤、年齢、BMI、人種、CD4陽性リンパ球数、対数変換したベースライン時の値、治療と来院の相互関係、ベースライン値と来院の相互関係を調整した対数変換データに、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 144週時/ベースライン時の調整比で示す。
※3 ベースライン時及び144週時の空腹時脂質値のデータがある患者で、ベースライン時に脂質異常症治療薬を投与している患者は除外した。脂質異常症治療薬の投与を開始した後は空腹時脂質の評価を打ち切り、欠測値はLOCFを用いて補完した。ベースライン時の脂質異常症治療薬の使用率は、DTG・3TC Switch群で13%、TAF継続群で15%であった。
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
脂質への影響
(投与196週)(安全性評価項目)
投与196週時におけるDTG・3TC 早期Switch群及びDTG・3TC 後期Switch群の空腹時脂質のベースライン時からの変化(平均変化率)を以下に示します。
ベースライン時からの空腹時脂質の変化率
(投与196週時、安全性解析対象集団)(安全性評価項目)
※1 DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
※2 ベースライン時及び196週時のデータがある患者。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
糖代謝への影響
(投与144週)(安全性評価項目)
投与144週時におけるDTG・3TC Switch群及びTAF継続群のHOMA-IRのベースライン時からの変化率(調整平均値※1)を下記に示します。
ベースライン時からのHOMA-IRの変化率(投与144週時、安全性解析対象集団)(安全性評価項目)
※1 治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、BMI、高血圧の既往、対数変換したベースライン時のHOMA-IR値、治療と来院の相互関係、ベースライン時の値と来院の相互関係を調整し、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
[Osiyemi O, et al. Clin Infect Dis. 2022; ciac036. doi: 10.1093/cid/ciac036. Online ahead of print.]
体重への影響
(投与144週)(安全性評価項目)
投与144週時におけるDTG・3TC Switch群及びTAF継続群の体重のベースライン時からの変化量(調整平均値※及び中央値)を下記に示します。
体重の変化(投与144週時、安全性解析対象集団)(安全性評価項目)
※1 治療、来院、ベースライン時の使用薬剤、CD4陽性リンパ球数、年齢、性別、人種、前治療のTAF投与期間、地域、BMIサブグループ、治療と来院の相互関係で調整し、治療とBMIサブグループの相互関係、BMIサブグループと来院の相互関係、治療、BMIサブグループと来院の相互関係、来院を反復因子として調整したMMRM(Mixed Model Repeated Measures)を用いて算出した。
※2 ベースライン時及び144週時のデータがある患者
[電子添文改訂時の評価資料:海外臨床試験(204862)]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
体重への影響
(投与196週)(安全性評価項目)
投与196週時におけるDTG・3TC 早期Switch群及びDTG・3TC後期Switch群の体重のベースライン時からの変化(平均変化量)を以下に示します。
体重の変化(投与196週時、安全性解析対象集団)(安全性評価項目)
※1 DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
※2 ベースライン時及び196週時のデータがある患者。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
炎症への影響
(投与144週)(安全性評価項目)
ベースラインおよび投与144週時におけるDTG・3TC Switch群及びTAF継続群の炎症マーカー値は以下の通りであった。
各種炎症マーカー値(投与144週時、安全性解析対象集団)(安全性評価項目)
[Wang R, et al.: Open Forum Infect Dis., 11(1): ofad626(2024)]
炎症への影響
(投与196週)(安全性評価項目)
投与196週時におけるDTG・3TC 早期Switch群及びDTG・3TC 後期Switch群の各種炎症マーカー値のベースライン時からの変化率(幾何平均比)を以下に示します。
各種炎症マーカー値(投与196週時、安全性解析対象集団)(安全性評価項目)
※1 DTG・3TC 早期Switch群のベースラインは無作為化1日目、DTG・3TC 後期Switch群のベースラインは148週時とした(148週時のデータが入手できない場合は、切り替え前の最新のデータをベースライン値とした)。
※2 対数変換値の幾何平均比で示す。
※3 ベースライン時及び196週時のデータがある患者。
[De Wit S, et al. J Acquir Immune Defic Syndr. 2024 Mar 1. Online ahead of print.]
TANGO試験 LImItatIon
この試験では、白人、男性、50歳未満、ベースラインにエルビテグラビルベースのboostedレジメンを使用した参加者の割合が高く、結果の一般化が制限される可能性があった。また、進行したHIV感染者の数は少なかった。試験は、非盲検試験であり、医師や参加者によるバイアスが生じる可能性があった。TAFベースのレジメンからDTG・3TCへの切り替え時期の変更により、TAF継続群4例が試験から自発的に離脱した(DTG・3TC Switch群に離脱例はなかった)。第48週の解析以降、COVID-19の流行により、741例中44例(6%)で第96週のデータが入手できず、その例数は群間で均等でなかった。144週目では、COVID-19の流行によるデータの欠落は7例のみであった。
[van Wyk J, et al.: Clin Infect Dis., 71(8), 1920-1929(2020)]
[Osiyemi O, et al.: Clin Infect Dis., 75(6), 975-986(2022)]
PM-JP-DLL-WCNT-220004 | 作成年月2024年12月

