「禁忌を含む注意事項等情報」等は、ドラッグインフォメーションをご参照ください。
ボカブリア水懸筋注およびリカムビス®水懸筋注は、海外臨床データに基づき承認されたため、審査で評価された海外臨床試験の結果を紹介します。
ATLAS-2M試験(海外データ)
ウイルス学的抑制が得られている成人HIV-1感染症患者を対象とした非盲検比較検証試験(非劣性試験)
試験デザイン
多施設共同、無作為化、非盲検、並行群間比較、実薬対照、第Ⅲb相非劣性検証試験(非劣性試験)
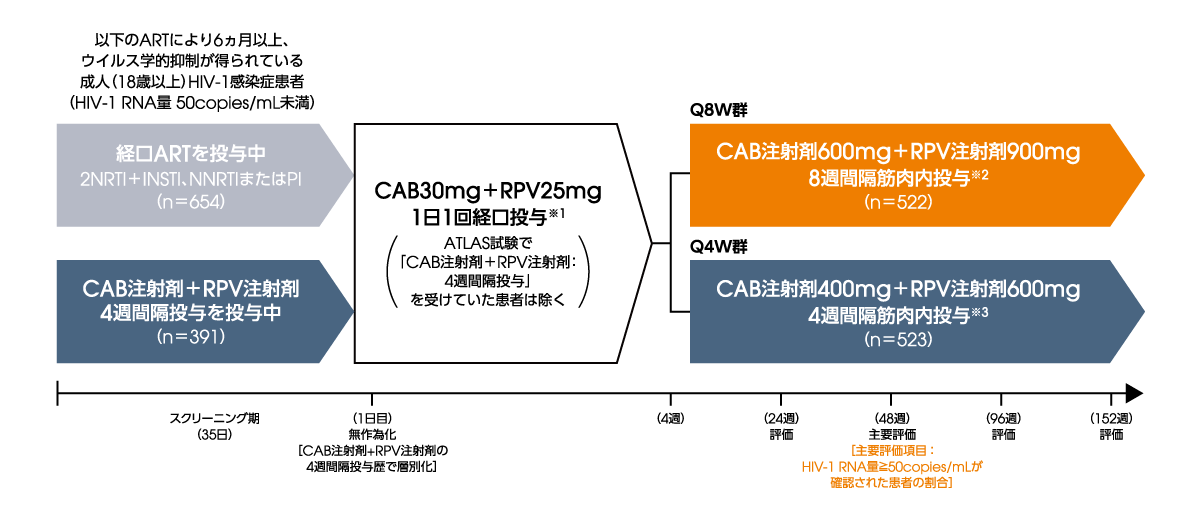
Q8W:8週間隔投与、Q4W:4週間隔投与
※1 食事中または食直後に投与
※2 初回および4週後にCAB注射剤600mg+RPV注射剤900mgを投与し、その後は8週間隔でCAB注射剤600mg+RPV注射剤900mgを投与
※3 初回はCAB注射剤600mg+RPV注射剤900mgを投与し、2回目以降は4週間隔でCAB注射剤400mg+RPV注射剤600mgを投与
患者背景(ITT-E集団)

Q8W:8週間隔投与、Q4W:4週間隔投与
※1 ARTの期間は、試験開始前の投与だけではなく、全曝露期間を示している。
※2 事後解析(全曝露期間には、CAB+RPVの経口投与が含まれる)。
※3 活動性B型肝炎ではないと考えられたため、試験に参加している。
※4 Stage1:HIV感染検査陽性でAIDSと定義される状態ではなくCD4陽性Tリンパ球数≧500cells/μLまたはCD4陽性Tリンパ球数が全リンパ球数の≧26%の場合
Stage2:HIV感染検査陽性でAIDSと定義される状態ではなくCD4陽性Tリンパ球数200~499cells/μLまたはCD4陽性Tリンパ球数が全リンパ球数の14%~25%の場合
Stage3:HIV感染検査陽性でCD4陽性Tリンパ球数が<200cells/μLまたはCD4陽性Tリンパ球数が全リンパ球数の<14%またはAIDSと定義される状態の場合
本邦で承認されたボカブリア水懸筋注およびリカムビス®水懸筋注の用法及び用量は、 1ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、以降はそれぞれ400mg、600mgを1ヵ月に1回投与)および2ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、初回投与後1ヵ月後にそれぞれ600mg、900mgを投与、以降はそれぞれ600mg、900mgを2ヵ月に1回投与)です。
引用文献
- Overton, E.T., et al.: Lancet 396(10267), 1994-2005(2020)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - Jaeger, H., et al.: Lancet HIV 8(11), e679-e689(2021)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - 承認時評価資料:海外臨床試験(207966)
PM-JP-CBR-WCNT-220004 | 作成年月2023年12月


