「禁忌を含む注意事項等情報」等は、ドラッグインフォメーションをご参照ください。
ボカブリア水懸筋注およびリカムビス®水懸筋注は、海外臨床データに基づき承認されたため、審査で評価された海外臨床試験の結果を紹介します。
ATLAS試験(海外データ)
ウイルス学的抑制が得られている成人HIV-1感染症患者を対象とした非盲検比較検証試験(非劣性試験)
有効性
抗ウイルス効果(投与48週後)
投与48週後に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、 CAB+RPV群で1.6%(5/308例)、CAR群で1.0%(3/308例)であり、CAB+RPV群のCAR群に対する非劣性が検証されました〔調整後の差※:0.6%[95%信頼区間:-1.2%, 2.5%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:6%)
層別化因子:ベースライン時のキードラッグ(INSTI、NNRTI、PI)、性別
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与48週後、ITT-E集団)
【主要評価項目:検証された結果】
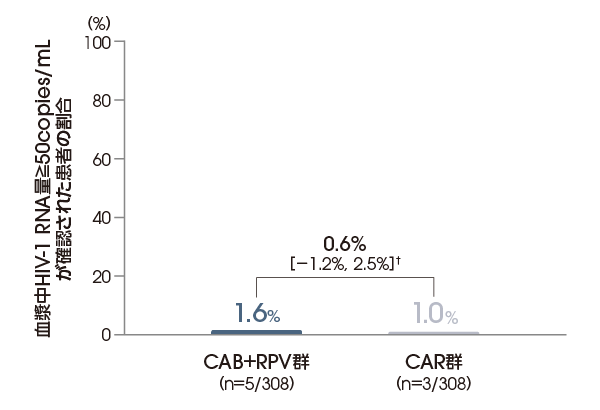
FDA Snapshotアルゴリズム解析
† 95%信頼区間
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与48週後、ITT-E集団)
【主要な副次評価項目】
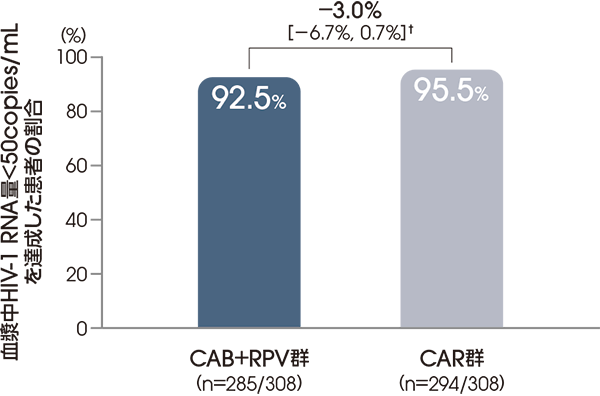
FDA Snapshotアルゴリズム解析
† 95%信頼区間
CVF時の耐性変異の発現(投与48週後)
【ウイルス学的エンドポイント】

※ ベースライン時のHIV-1 RNA検体で検出された既存の耐性関連変異
<参考情報>
治療法の選好性への影響
投与48週後に、CAB+RPV群において、治療法の選好性を選択形式の質問※により評価しました。その結果、CAB注射剤+RPV注射剤の治療を好むと回答した患者は86%(266/308例)、経口ARTの治療を好むと回答した患者は2%(7/308例)、無回答が12%(35/308例)でした。
●投与48週後の治療法の選好性(CAB+RPV群、ITT-E集団)
【探索的評価項目】
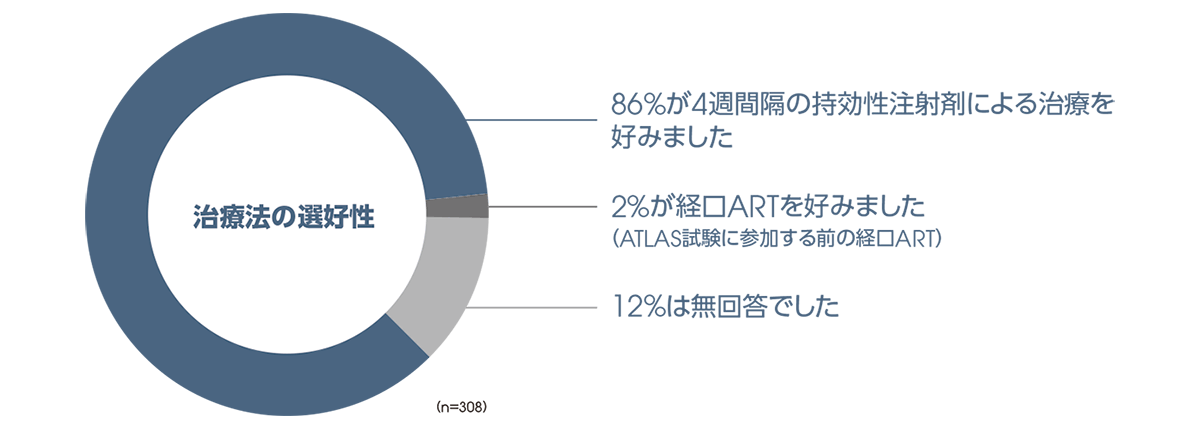
※ CAB+RPV群の患者から、「CAB注射剤+RPV注射剤の治療」「経口ARTの治療」のうち好ましい治療法の回答を得た。
本邦で承認されたボカブリア水懸筋注およびリカムビス®水懸筋注の用法及び用量は、 1ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、以降はそれぞれ400mg、600mgを1ヵ月に1回投与)および2ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、初回投与後1ヵ月後にそれぞれ600mg、900mgを投与、以降はそれぞれ600mg、900mgを2ヵ月に1回投与)です。
引用文献
- Swindells, S., et al.:N Engl J Med 382(12), 1112-1123(2020)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - 承認時評価資料:海外臨床試験(201585)
PM-JP-CBR-WCNT-220004 | 作成年月2023年12月


