「禁忌を含む注意事項等情報」等は、ドラッグインフォメーションをご参照ください。
ボカブリア水懸筋注およびリカムビス®水懸筋注は、海外臨床データに基づき承認されたため、審査で評価された海外臨床試験の結果を紹介します。
ATLAS-2M試験(海外データ)
ウイルス学的抑制が得られている成人HIV-1感染症患者を対象とした非盲検比較検証試験(非劣性試験)
有効性
投与48週後において、ボカブリア+リカムビス®Q8W群のQ4W群に対する有効性の非劣性が検証されました
抗ウイルス効果(投与48週後)
投与48週後に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、Q8W群で1.7%(9/522例)、Q4W群で1.0%(5/523例)であり、Q8W群のQ4W群に対する非劣性が検証されました 〔調整後の差※:0.8%[95%信頼区間:-0.6%, 2.2%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:4%)
層別化因子:本試験を開始する前のCAB注射剤+RPV注射剤(4週間隔)の投与歴(0週、1~24週、>24週)
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与48週後、ITT-E集団)
【主要評価項目:検証的な解析項目】
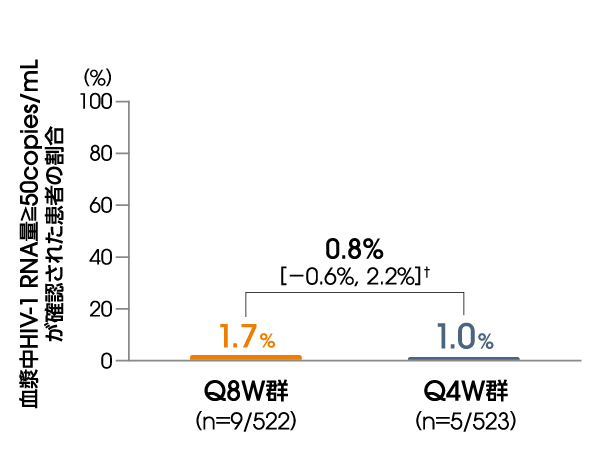
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与48週後、ITT-E集団)
【主要な副次評価項目】
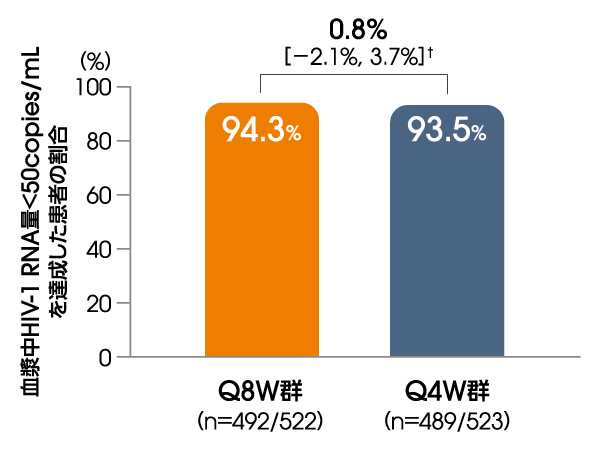
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
抗ウイルス効果(投与96週後)
投与96週後に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、Q8W群で2.1%(11/522例)、Q4W群で1.1%(6/523例)でした〔調整後の差※:1.0%[95%信頼区間:-0.6%, 2.5%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:4%)
層別化因子:本試験を開始する前のCAB注射剤+RPV注射剤(4週間隔)の投与歴(0週、1~24週、>24週)
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】
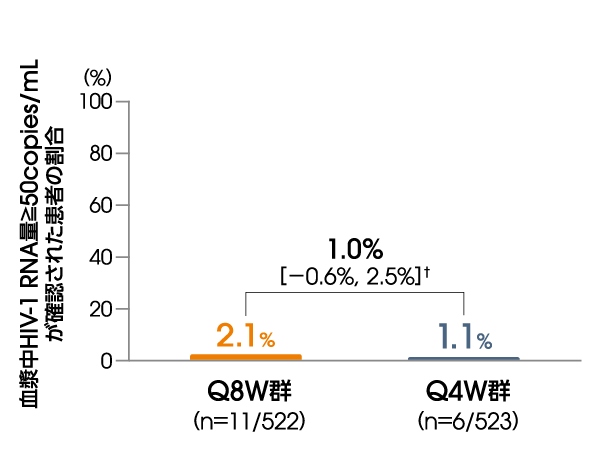
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】
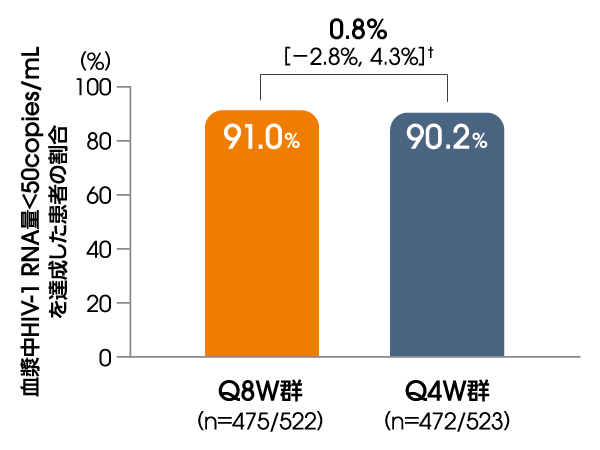
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
抗ウイルス効果(投与152週後)
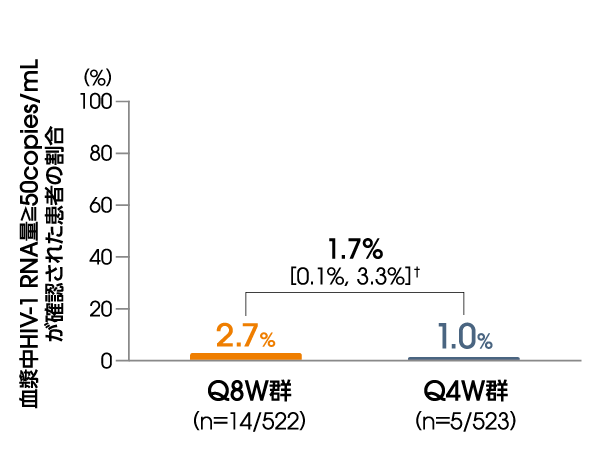
投与152週後に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、Q8W群で2.7%(14/522例)、Q4W群で1.0%(5/523例)でした〔調整後の差※:1.7%[95%信頼区間:0.1%, 3.3%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:4%)
層別化因子:本試験を開始する前のCAB注射剤+RPV注射剤(4週間隔)の投与歴(0週、1~24週、>24週)
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与152週後、ITT-E集団)
【その他の副次評価項目】
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
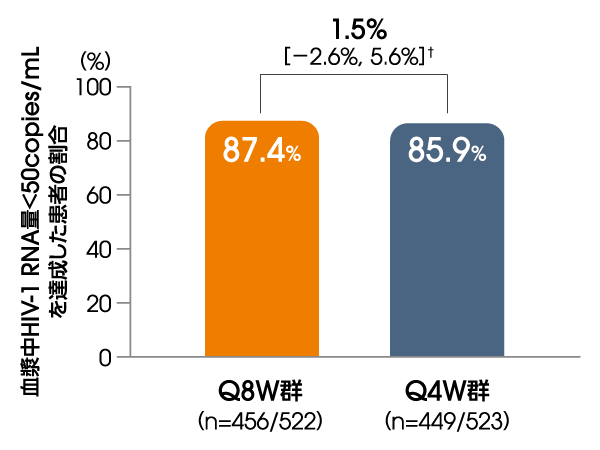
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与152週後、ITT-E集団)
【その他の副次評価項目】
FDA Snapshotアルゴリズム解析
† 95%信頼区間
Q8W:8週間隔投与、Q4W:4週間隔投与
投与152週後にCVFが認められた患者における耐性変異の発現
●CVF※1が認められた患者における耐性変異の発現(投与152週後)
【ウイルス学的エンドポイント】

ボカブリア水懸筋注およびリカムビス®水懸筋注は海外臨床データに基づき承認されたため、審査で評価された海外臨床試験の結果を紹介します。本解析は、国際共同第Ⅲ相試験(FLAIR試験)および海外第Ⅲ相試験(ATLAS試験およびATLAS-2M試験)の事後解析データが含まれる併合解析ですが、承認審査過程で評価されたため掲載しています。
ボカブリア+リカムビス®が投与された成人HIV-1感染症患者1039例の48週時の多変量解析に基づき、CVFの予測因子が検討されました(海外データ)。
・CVFを予測する単独の因子はありませんでした。
・以下の因子が0または1であった場合、CVF発現率は0.5%未満でした。
・以下の因子が少なくとも2つ以上が組み合わさった場合、CVF発現率は25.7%でした。
■プロウイルスのRPV耐性関連変異
■HIV-1サブタイプA6/A1
■BMI≧30kg/m2
Cutrell,A.G.,etal.:AIDS35(9),1333-1342(2021)
著者には、過去にヴィーブヘルスケア(株)およびヤンセンファーマ(株)が人件費、助成金、コンサルタント料を支払った者が含まれる。著者には、ヴィーブヘルスケア(株)から金銭以外の支援、研究支援を受けた者が含まれる。著者には、ヴィーブヘルスケア(株)およびヤンセンファーマ(株)の社員が含まれる。
承認時評価資料:国際共同第Ⅲ相試験(201584)、海外臨床試験(201585、207966)の併合解析
Q8W:8週間隔投与、Q4W:4週間隔投与
※1 血漿中HIV-1 RNA量≧200copies/mLが2回連続して検出された場合
※2 T97A、Q148Q/R 、Q148R*、N155N/H 、N155H*
※3 E138E/K、Q148R、N155N/H
※4 K101E*、E138E/K、E138A*,**、Y181Y/C 、Y181C、Y188L**、P225H、M230M/L
※5 K101E、M230L
*単一あるいは複合
**ベースライン時の末梢血単核細胞の検体で検出された既存の耐性変異
<参考情報>
治療法の選好性への影響
投与48週後に、CAB注射剤+RPV注射剤の4週間隔投与歴のないQ8W群の患者において、治療法の選好性を選択形式の質問※1により評価しました。
その結果、CAB注射剤+RPV注射剤 Q8Wの治療を好むと回答した患者は98%(300/306例)、CAB+RPVの1日1回経口治療を好むと回答した患者は1%(4/306例)、無回答が1%(2/306例)でした。
●Q8W群における治療法の選好性(投与48週後)
【ヘルスケアアウトカムエンドポイント】
CAB注射剤+RPV注射剤(4週間隔投与)の投与歴がなく、経口ARTから移行したQ8W群※2

Q8W:8週間隔投与
※1 Q8W群の患者から、「CAB注射剤+RPV注射剤 Q8Wの治療」「CAB+RPVの1日1回経口治療」のうち好ましい治療法の回答を得た。
※2 306例が質問に回答した。
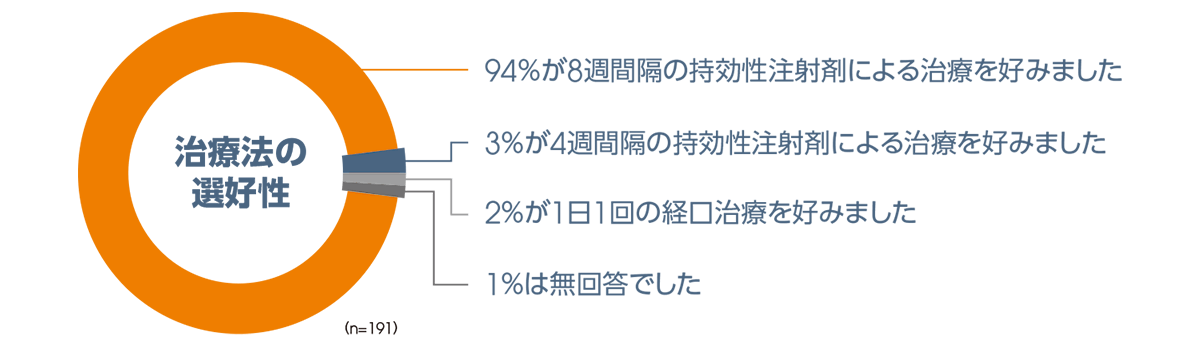
投与48週後に、ATLAS試験におけるCAB注射剤+RPV注射剤(4週間隔投与)から移行したQ8W群の患者において、治療法の選好性を選択形式の質問※1により評価しました。
その結果、CAB注射剤+RPV注射剤の4週間隔投与歴のあるQ8W群の患者では、CAB注射剤+RPV注射剤 Q8Wの治療を好むと回答した患者は94%(179/191例)、CAB注射剤+RPV注射剤 Q4Wの治療を好むと回答した患者は3%(6/191例)、CAB+RPVの1日1回経口治療を好むと回答した患者は2%
(4/191例)、無回答が1%(2/191例)でした。
●Q8W群における治療法の選好性(投与48週後)
【ヘルスケアアウトカムエンドポイント】
ATLAS試験におけるCAB注射剤+RPV注射剤(4週間隔投与)から移行したQ8W群※2
Q8W:8週間隔投与、Q4W:4週間隔投与
※1 Q8W群の患者から、「CAB注射剤+RPV注射剤 Q8Wの治療」「CAB+RPVの1日1回経口治療」「CAB注射剤+RPV注射剤 Q4Wの治療」のうち好ましい治療法の回答を得た。
※2 191例が質問に回答した。
本邦で承認されたボカブリア水懸筋注およびリカムビス®水懸筋注の用法及び用量は、 1ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、以降はそれぞれ400mg、600mgを1ヵ月に1回投与)および2ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、初回投与後1ヵ月後にそれぞれ600mg、900mgを投与、以降はそれぞれ600mg、900mgを2ヵ月に1回投与)です。
引用文献
- Overton, E.T., et al.: Lancet 396(10267), 1994-2005(2020)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - Jaeger, H., et al.: Lancet HIV 8(11), e679-e689(2021)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - Overton,E.T.,et al.:Clin Infect Dis 76(9),1646-1654(2023)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - 承認時評価資料:海外臨床試験(207966)
PM-JP-CBR-WCNT-220004 | 改訂年月2025年11月


