「禁忌を含む注意事項等情報」等は、ドラッグインフォメーションをご参照ください。
FLAIR試験(日本人を含む海外データ)
抗HIV薬による治療経験のない成人HIV-1感染症患者を対象とした非盲検比較検証試験(非劣性試験)
有効性
抗ウイルス効果(投与48週後)
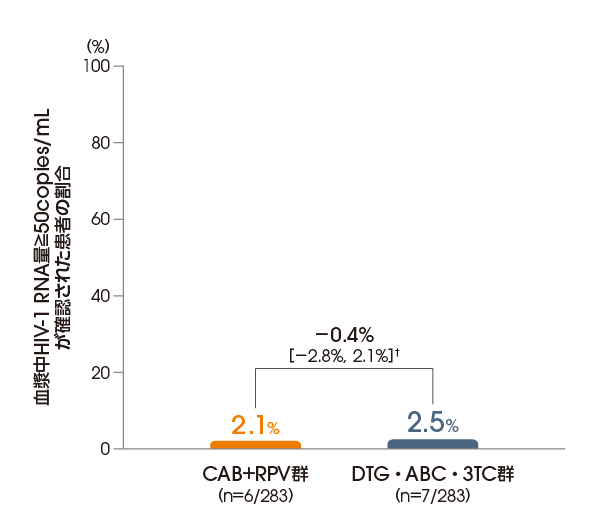
投与48週後(維持療法期)に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、CAB+RPV群で2.1%(6/283例)、DTG・ABC・3TC群で2.5%(7/283例)であり、CAB+RPV群のDTG・ABC・3TC群に対する非劣性が検証されました〔調整後の差※:-0.4%[95%信頼区間:-2.8%, 2.1%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:6%)
層別化因子:導入療法期のベースライン時の血漿中HIV-1RNA量(<100,000copies/mL、≧100,000copies/mL)及び性別
血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合
(投与48週後、ITT-E集団)
【主要評価項目:検証的な解析項目】
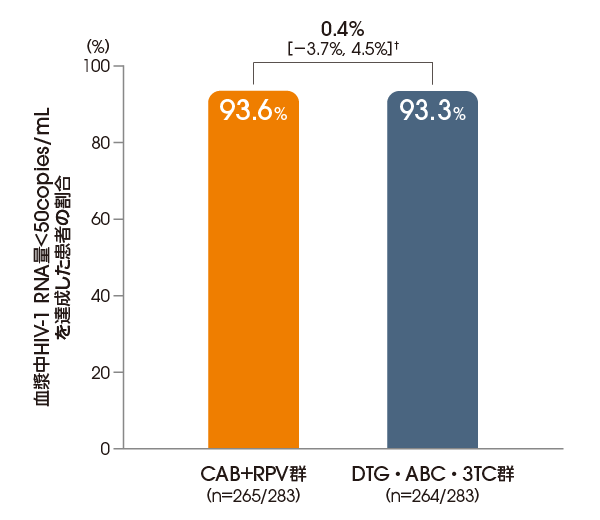
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
(投与48週後、ITT-E集団)
【主要な副次評価項目】
FDA Snapshotアルゴリズム解析
† 95%信頼区間
FDA Snapshotアルゴリズム解析
† 95%信頼区間
血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合
(投与48週後、ITT-E集団)
【主要評価項目:検証された結果】

FDA Snapshotアルゴリズム解析
† 95%信頼区間
血漿中HIV-1 RNA量<50copies/mLを達成した患者の割合
(投与48週後、ITT-E集団)
【主要な副次評価項目】

FDA Snapshotアルゴリズム解析
† 95%信頼区間
抗ウイルス効果(投与96週後)
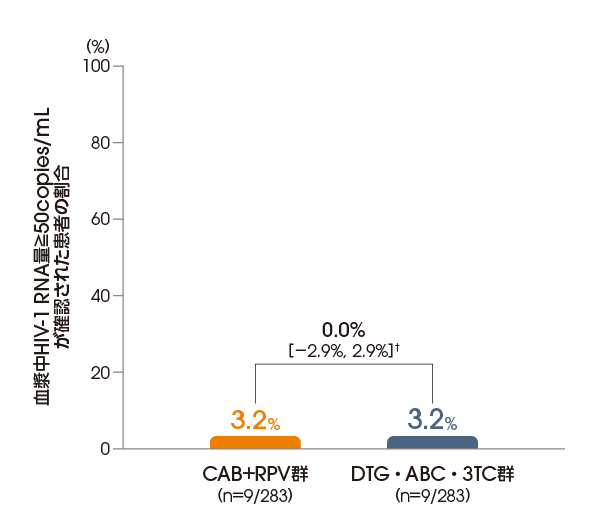
投与96週後(維持療法期)に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、CAB+RPV群で3.2%(9/283例)、DTG・ABC・3TC群で3.2%(9/283例)でした〔調整後の差※:0.0%[95%信頼区間:-2.9%, 2.9%]〕(FDA Snapshotアルゴリズム解析)。
※ Cochran-Mantel-Haenszelを用いた層別解析に基づく調整済みの差(非劣性マージン:6%)
層別化因子:導入療法期のベースライン時の血漿中HIV-1RNA量(<100,000copies/mL、≧100,000copies/mL)及び性別
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】
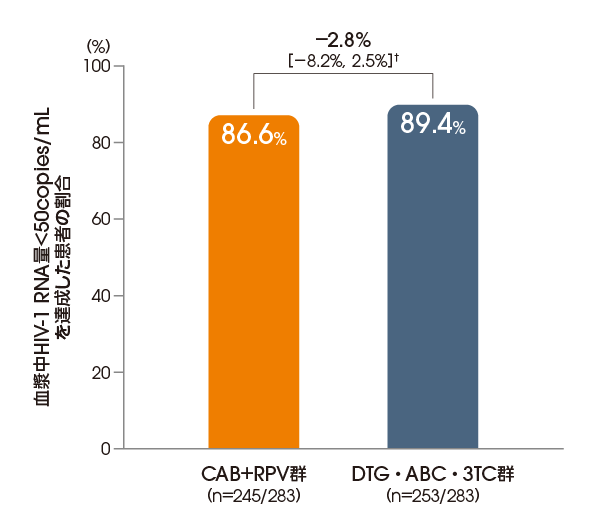
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】
FDA Snapshotアルゴリズム解析
† 95%信頼区間
FDA Snapshotアルゴリズム解析
† 95%信頼区間
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】

FDA Snapshotアルゴリズム解析
† 95%信頼区間
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与96週後、ITT-E集団)
【その他の副次評価項目】

FDA Snapshotアルゴリズム解析
† 95%信頼区間
抗ウイルス効果(投与124週後)
投与124週後(延長療法期)に血漿中HIV-1 RNA量≧50copies/mLが確認された患者の割合は、ITT-E集団において、CAB+RPV継続群で4.9%(14/283例)でした(FDA Snapshotアルゴリズム解析)。
CAB+RPV継続群において
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与124週後、ITT-E集団)
【その他の副次評価項目】
CAB+RPV継続群において
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与124週後、ITT-E集団)
【その他の副次評価項目】
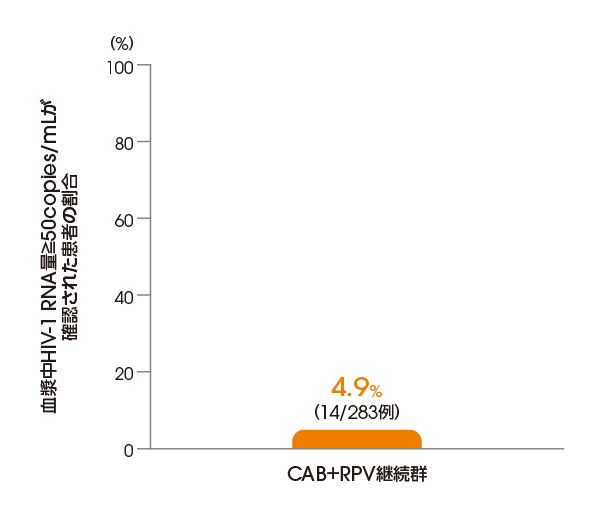
FDA Snapshotアルゴリズム解析
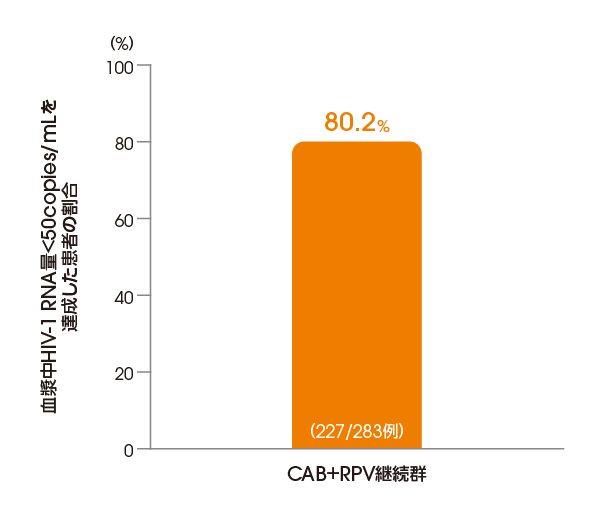
FDA Snapshotアルゴリズム解析
CAB+RPV継続群において
血漿中HIV-1 RNA量≧50copies/mLが
確認された患者の割合
(投与124週後、ITT-E集団)
【その他の副次評価項目】

FDA Snapshotアルゴリズム解析
CAB+RPV継続群において
血漿中HIV-1 RNA量<50copies/mLを
達成した患者の割合
(投与124週後、ITT-E集団)
【その他の副次評価項目】

FDA Snapshotアルゴリズム解析
CVF時の耐性変異の発現(投与48週後および96週後)【その他の副次評価項目】

※1 1例〔HIV-1サブタイプ:AG〕は、妊娠検査偽陽性のためCAB+RPVの経口投与を一時中断したが、その後再開し、CVFが確認された。しかし、CAB注射剤+RPV注射剤の筋肉内投与を開始する前に治療が中断され、耐性変異の発現は認められなかった。
※2 1例はG140R(CABに対するFC=6.7、DTGに対するFC=2.2)、2例はQ148R(CABに対するFC=5.2、9.4、DTGに対するFC=1.0、1.1)
※3 1例はK101E(RPVに対するFC=2.63)、1例はE138E/A/K/T(RPVに対するFC=7.1)、1例はE138K(RPVに対するFC=1.0)
※4 V179V/I (RPVに対するFC=0.5)〔HIV-1サブタイプ:A1〕
注:G140RとK101E〔HIV-1サブタイプ:A1〕、Q148RとE138E/A/K/T〔HIV-1サブタイプ:A1〕、Q148RとE138K〔HIV-1サブタイプ:A1〕はそれぞれ同一症例
CAB+RPV継続群のCVF時の耐性変異の発現(投与124週後)【その他の副次評価項目】

※1 N155H、R263K(CABに対するFC=9.0、DTGに対するFC=3.78)〔HIV-1サブタイプ:A1〕
※2 V106V/A、V108V/I、E138G、M230L(RPVに対するFC=27)〔HIV-1サブタイプ:A1〕
本邦で承認されたボカブリア水懸筋注およびリカムビス®水懸筋注の用法及び用量は、 1ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、以降はそれぞれ400mg、600mgを1ヵ月に1回投与)および2ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、初回投与後1ヵ月後にそれぞれ600mg、900mgを投与、以降はそれぞれ600mg、900mgを2ヵ月に1回投与)です。
引用文献
- Orkin, C., et al. : N Engl J Med 382(12), 1124-1135(2020)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - 承認時評価資料:国際共同第Ⅲ相試験(201584)
PM-JP-CBR-WCNT-220004 | 改訂年月2025年11月


