「禁忌を含む注意事項等情報」等は、ドラッグインフォメーションをご参照ください。
FLAIR試験(日本人を含む海外データ)
抗HIV薬による治療経験のない成人HIV-1感染症患者を対象とした非盲検比較検証試験(非劣性試験)
安全性
導入療法期(20週間)における有害事象
DTG・ABC・3TCによる導入療法期において、34%(95/283例)に有害事象の発現が認められました。主な有害事象は、下痢3%(9/283例)、ビタミンD欠乏4%(12/283例)、頭痛3%(8/283例)でした。
なお、重篤な有害事象は、3例(腸炎、発熱、A型肝炎)に認められましたが、治験薬との関連は認められませんでした。投与中止に至った有害事象は、5例[A型肝炎ウイルス感染、高トランスアミナーゼ血症(スクリーニング時にHCV抗体陽性で、違法薬物の使用が報告されている)、C型肝炎ウイルス感染、フォローアップ不可、CVF(妊娠検査偽陽性のため治療を中止)]に認められましたが、肝炎及び高トランスアミナーゼ血症は治験薬との関連が認められませんでした。死亡は、導入療法期(DTG・ABC・3TCを服用)で1例に認められましたが、死因は殺人である可能性があり、治験薬との因果関係は否定されました。
維持療法期における副作用、重篤な副作用、投与中止に至った副作用、死亡
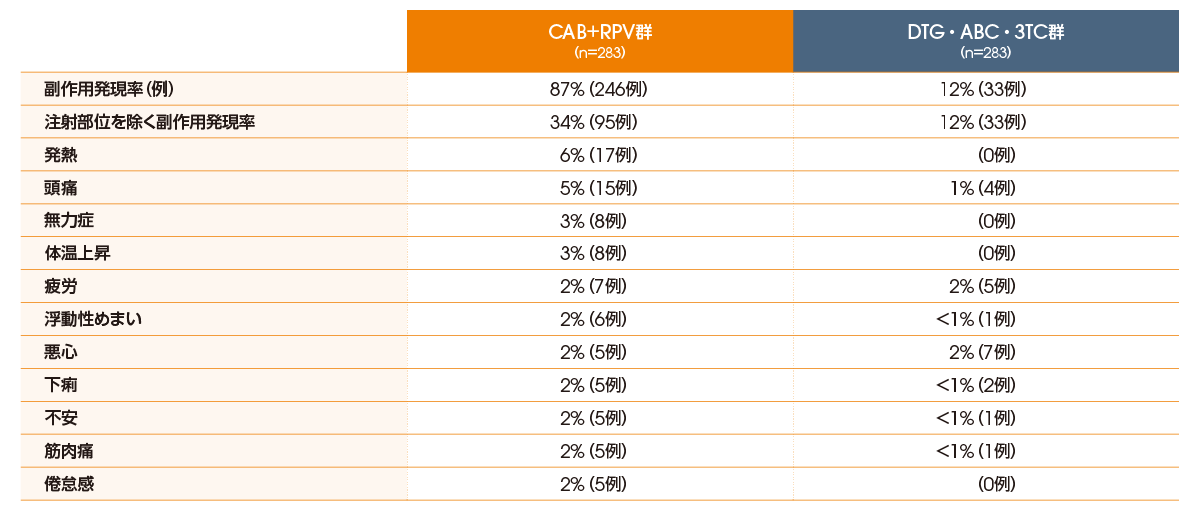
投与100週後の副作用発現率は、CAB+RPV群で87%(246/283例)、DTG・ABC・3TC群で12%(33/283例)であり、CAB+RPV群では、注射部位反応を除くと34%(95/283例)でした。注射部位反応を除く主な副作用(いずれかの群における発現率≧2%)は表の通りでした。
なお、重篤な副作用はCAB+RPV群の1例1件(関節炎1件)に認められ、DTG・ABC・3TC群では認められませんでした。投与中止に至った副作用は、CAB+RPV群で5例8件(注射部位疼痛3件、抑うつ2件、不快感、嘔吐、下痢各1件)、DTG・ABC・3TC群で3例7件(注意障害、構音障害、健忘症、腎不全、浮動性めまい、疲労、悪心各1件)に認められました。維持療法期において死亡は認められませんでした。
●注射部位反応を除く主な副作用の発現率(投与100週後、安全性解析対象集団)(いずれかの群における発現率≧2%)
CAB+RPV継続群の延長療法期における副作用、重篤な副作用、投与中止に至った有害事象、死亡
本試験における投与124週後の副作用発現率は、CAB+RPV継続群で88%(248/283例)でした。
注射部位反応を除く主な副作用(発現率≧2%)は表の通りでした。
なお、重篤な副作用はCAB+RPV継続群の1例1件(関節炎1件)に認められました。投与中止に至った有害事象は、CAB+RPV継続群で15例19件(A型肝炎、注射部位疼痛各3件、急性B型肝炎、抑うつ各2件、急性C型肝炎、C型肝炎、第2期梅毒、不快感、下痢、嘔吐、過量投与、トランスアミナーゼ上昇、結腸腺癌各1件)に認められました。延長療法期において死亡は認められませんでした。
●CAB+RPV継続群の注射部位反応を除く主な副作用の発現率(投与124週後、安全性解析対象集団)(発現率≧2%)

注射部位反応
投与100週後における注射部位反応は、CAB+RPV群で88%(245/283例)に認められました。主な注射部位反応(副作用)は、注射部位疼痛82%(232/283例)でした。症状の持続期間は、3.0日(中央値)でした。
投与124週後における注射部位反応は、CAB+RPV継続群で89%(247/283例)に認められました。主な注射部位反応(副作用)は、注射部位疼痛83%(236/283例)でした。症状の持続期間は、3.0日(中央値)でした。
CAB+RPV群における投与96週までの注射部位反応の発現率は表の通りでした。
●注射部位反応の発現数(投与100週後および124週後、安全性解析対象集団)
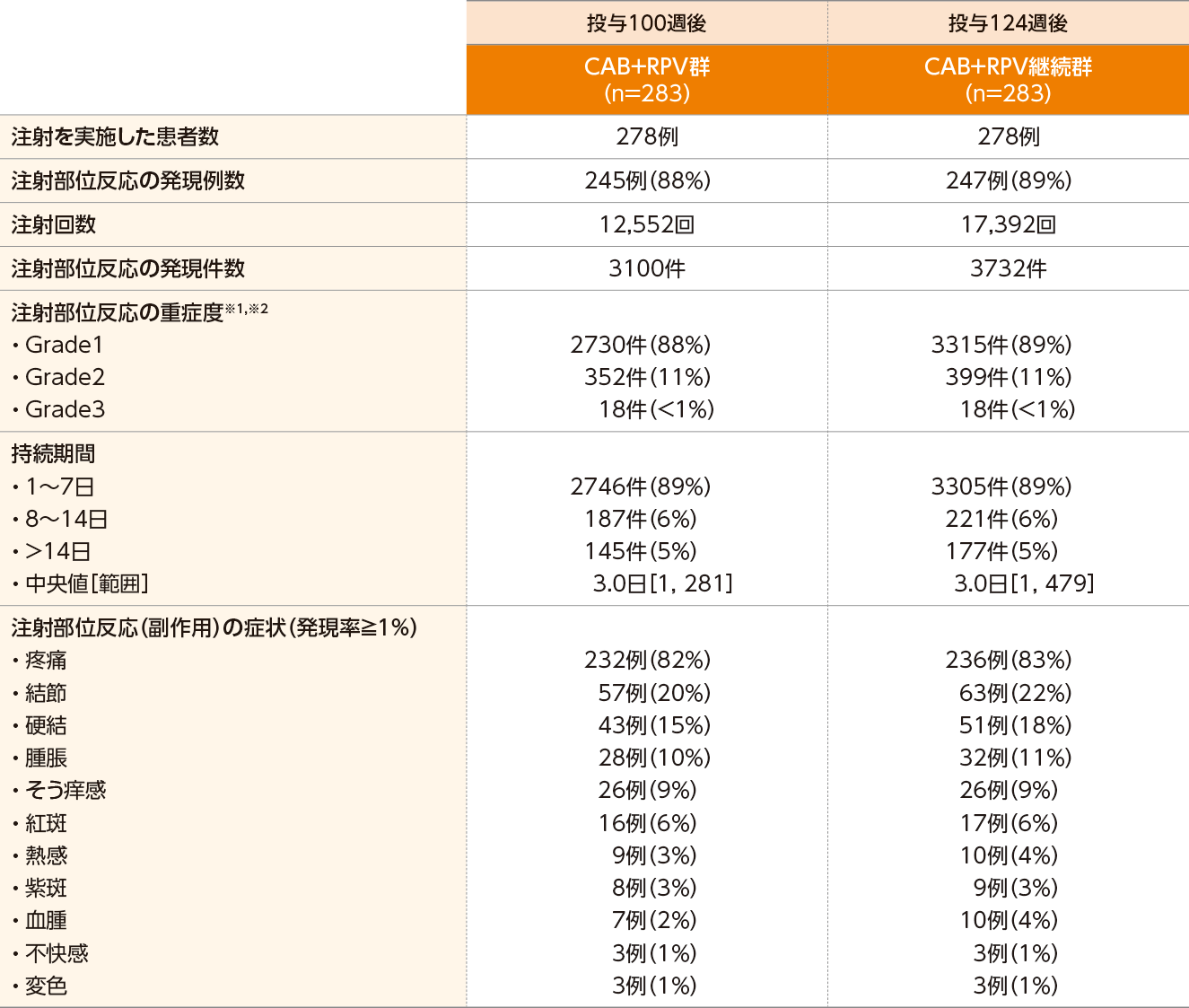
※1 Grade1:症状を伴う/伴わない圧痛(例:熱感、紅斑、そう痒)、Grade2:疼痛;脂肪変性;浮腫;静脈炎、Grade3:潰瘍または壊死;高度の組織損傷;外科的処置を要する、Grade4:生命を脅かす;緊急処置を要する、Grade5:死亡 [有害事象共通用語規準 v5.0日本語訳JCOG版]
※2 Grade4、重篤、致死的な注射部位反応は認められなかった。
●CAB+RPV群における注射部位反応の発現率
(投与96週まで、安全性解析対象集団)

本邦で承認されたボカブリア水懸筋注およびリカムビス®水懸筋注の用法及び用量は、 1ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、以降はそれぞれ400mg、600mgを1ヵ月に1回投与)および2ヵ月間隔投与(CAB注射剤600mg及びRPV注射剤900mgを投与し、初回投与後1ヵ月後にそれぞれ600mg、900mgを投与、以降はそれぞれ600mg、900mgを2ヵ月に1回投与)です。
引用文献
- Orkin, C., et al. : N Engl J Med 382(12), 1124-1135(2020)
[本試験に関する費用は、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の支援を受けた。著者には、ヴィーブヘルスケア(株)及びヤンセンファーマ(株)の社員が含まれる。] - 承認時評価資料:国際共同第Ⅲ相試験(201584)
PM-JP-CBR-WCNT-220004 | 改訂年月2025年11月


